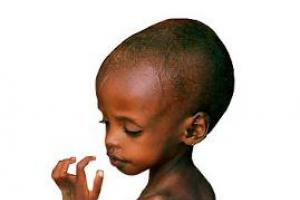
Nie będzie dla nikogo tajemnicą, że prawidłowe odżywianie ma ogromne znaczenie w życiu każdego człowieka. To samo dotyczy dzieci. W tym artykule chciałbym szczegółowo omówić taki problem, jak niedożywienie białkowo-energetyczne.
Co to jest?
Już na samym początku trzeba zdecydować, jakie koncepcje zostaną wykorzystane w artykule. Czym jest niedobór białkowo-energetyczny, jest chyba jasne dla każdego. Jest to brak białka w organizmie dziecka. Warto również wyjaśnić, że ten stan jest patologiczny. Mówiąc dokładniej, organizm ludzki otrzymuje za mało białka lub nie otrzymuje go wcale w jakiejkolwiek formie. Może to być również spowodowane zbyt szybkim rozkładem substancji. W takim przypadku przyczyną tego zjawiska mogą być oparzenia, choroby ropno-septyczne lub poważne obrażenia.
Główne powody
Dlaczego może wystąpić niedożywienie białkowo-energetyczne? Warto powiedzieć, że problem ten jest bardzo powszechny wśród mieszkańców krajów rozwijających się. W okresach strajku głodowego odsetek osób chorych na tę chorobę sięga 25%. W tym przypadku przyczyną jest niewystarczająca ilość lub niska jakość pożywienia. Problem pogłębia brak dostaw energii. A wszystko dlatego, że aminokwasy z pożywienia w tym przypadku nie są wykorzystywane w pożywieniu, są one utleniane w celu wytworzenia energii.
Niedożywienie białkowo-energetyczne może wystąpić wtórnie u dzieci z następujących powodów:
- Zakłócenie procesów trawiennych (zmniejszone wchłanianie składników odżywczych).
- Utrata białka może nastąpić w wyniku regulacji neuroendokrynnej.

Formularze
- Marazm. W tym przypadku wzrost dziecka jest opóźniony i obserwuje się podskórną tkankę tłuszczową.
- Kwashiorkor. To właśnie izolowany niedobór białka. Oprócz opóźnienia wzrostu dziecko może mieć obrzęk i jednak w tym przypadku pozostaje tłuszcz podskórny.
Powaga
Jeśli mówimy o problemie takim jak niedożywienie białkowo-energetyczne, należy również porozmawiać o jego stopniu. Jest ich tylko trzech:
- Łatwe (po pierwsze, ja).
- Umiarkowany (drugi, II).
- Ciężki (trzeci, III).

Łagodny stopień
Jeśli mówimy o łagodnym stopniu niedoboru białka, organizm dziecka jest jedynie osłabiony. W tym przypadku zmniejsza się jego odporność na różne wirusy i infekcje. Główne objawy, które będą obecne to:
- Rosnąca słabość.
- Letarg dziecka i niska zdolność do pracy.
- Szybkie zmęczenie nie tylko fizyczne, ale także psychiczne.
- Chłód, uczucie zimna.
- Pragnienie i głód. Może wystąpić zwiększone oddawanie moczu.
- Możliwe są zawroty głowy.
- Wystąpi drętwienie kończyn dolnych.
Na tym etapie rozwój dziecka może być również opóźniony.
Umiarkowany stopień
Rozważamy dalej taki problem, jak niedożywienie białkowo-energetyczne. Choroba w stadium 2 (pierwszym) występuje najczęściej u mieszkańców krajów rozwijających się. W tym przypadku, jak wspomniano powyżej, następuje wzrost dzieci. Jednak drugi stopień charakteryzuje się również zmianami biochemicznymi w organizmie. W ten sposób następuje znaczne osłabienie odporności komórkowej. A to prowadzi do zwiększonej wrażliwości na różnego rodzaju wirusy i infekcje.

Ciężka forma
Występuje również głębokie lub ciężkie niedożywienie białkowo-energetyczne (tj. kacheksja). Jednak jest to bardziej typowe dla osób chorych na raka. W takim przypadku dziecko może bardzo szybko schudnąć i pojawia się biegunka. Cierpią także mięśnie pacjenta, kończyny przypominają patyki pokryte skórą. Włosy stają się matowe, łamliwe i wypadają. Może wystąpić zatrzymanie wody w tkankach, często prowadzące do obrzęku. Nieodwracalne zmiany zachodzą także w narządach wewnętrznych pacjenta. Wszystko to jest jednak indywidualne (lekarz może o tym powiedzieć po pewnych badaniach). Inne objawy charakterystyczne dla takiego problemu, jak ciężkie niedożywienie białkowo-energetyczne u dzieci:
- Apatia, zmęczenie.
- Ciągłe uczucie zimna.
- Depigmentacja skóry i włosów.
- Skóra staje się sucha i popękana. Twarz dziecka nabiera starczego wyglądu.
- Spada ciśnienie krwi, tętno i temperatura.
Izolowana forma
Dość rzadko, ale nadal może wystąpić izolowana postać niedoboru białka. Najczęściej towarzyszy mu niedobór takich składników jak witaminy B1, B2, B6, kwas foliowy i nikotynowy, witamina A. Jeśli mówimy o dzieciach, to niedobór witaminy A stwarza dla dzieci zagrożenie.W miarę postępu choroby dochodzi do wewnątrzkomórkowych następuje utrata potasu, fosforu i magnezu.

Leczenie
Jeśli mówimy o takim problemie, jak niedobór białkowo-energetyczny, na leczeniu również należy skupić swoją uwagę. Tak więc, jeśli u dziecka występuje jedna z dwóch pierwszych postaci choroby, problem nadal można rozwiązać, dostosowując dietę. W tym przypadku bardzo ważne jest zwiększenie dziennego spożycia białka. Będzie się różnić dla dzieci w różnym wieku:
- Jeśli dziecko ma od roku do siedmiu lat, dzienna dawka będzie wynosić około 3-4 gramy białka na 1 kg masy ciała.
- Zapotrzebowanie na białko u dzieci w wieku szkolnym jest nieco niższe: 2-3 gramy na 1 kg masy ciała.
Dziecko otrzyma kompleksy multiwitaminowe. Przecież samo jedzenie w tym przypadku nie wystarczy. Można również przeprowadzić regulację równowagi wodno-elektrolitowej.
Jeśli u dziecka wystąpi poważny niedobór białka i energii, zostanie ono wysłane do szpitala. Nie da się poradzić sobie z tym problemem samodzielnie w domu. Co będzie istotne w tym przypadku:
- Kontrolowana dieta.
- Korekta równowagi wodno-elektrolitowej za pomocą terapii infuzyjnej.
- Dodatkowe odżywianie będzie również przepisywane mieszankami bogatymi w składniki odżywcze.
- Jeśli wchłanianie jest zaburzone, dziecku zostanie przepisany (wlew składników odżywczych).
- Terapia witaminowa. Jednak w tym przypadku będzie to wyjątkowe. Tacy ludzie potrzebują dwa razy więcej witamin niż osoba zdrowa. I tak jest do momentu wyzdrowienia.
- Pacjentom z anoreksją można przepisać leki zwiększające apetyt. Jeśli chcesz zwiększyć masę mięśniową, lekarze mogą przepisać sterydy anaboliczne.

Zapobieganie
Aby uniknąć niedożywienia białkowo-energetycznego u dzieci, należy uważnie monitorować ich dietę. Następujące produkty pomogą wypełnić Twoje jedzenie białkiem:
- Mięso z kurczaka.
- Ryba.
- Wołowina.
- Jajka.
- Nabiał.
Jednocześnie należy pamiętać również o innych przydatnych mikroelementach. Oprócz białka dziecko musi otrzymywać z pożywienia odpowiednią ilość węglowodanów i tłuszczów.
ŻYWIENIE W PRZYPADKU NIEDOBORU BIAŁKO-ENERGII (ICD-10 E44)
W Rosji przez wiele lat przyjęto termin niedożywienie, który jest synonimem niedożywienia białkowo-energetycznego.
Hipotrofia (zaburzony stan odżywienia) to stan charakteryzujący się chronicznym niedożywieniem i brakiem masy ciała w stosunku do wzrostu i wieku.
W zależności od czasu wystąpienia rozróżnia się niedożywienie prenatalne (wrodzone, wewnątrzmaciczne) i niedożywienie poporodowe (rozwinięte po urodzeniu). Niedożywienie prenatalne opiera się na naruszeniu rozwoju wewnątrzmacicznego płodu ze względu na konstytucyjne cechy matki, niewydolność krążenia łożyskowego, narażenie na zakaźne, dziedziczne, niekorzystne czynniki społeczno-ekonomiczne, przemysłowe i środowiskowe.
W okresie poporodowym niedożywienie może rozwinąć się pod wpływem czynników endogennych lub egzogennych (tab. 24).
Tabela 24. Czynniki predysponujące do rozwoju niedożywienia w okresie poporodowym
|
Czynniki endogenne |
Czynniki egzogenne |
|
Wady wrodzone (układ sercowo-naczyniowy, przewód pokarmowy, ośrodkowy układ nerwowy, układ moczowo-płciowy, wątroba) Wrodzone lub nabyte zmiany w ośrodkowym układzie nerwowym (niedokrwienie mózgu, okołoporodowe uszkodzenie układu nerwowego, krwotok śródczaszkowy) Zespoły złego wchłaniania (z niedoborem laktazy, celiakią, mukowiscydozą itp.) Dziedziczne niedobory odporności Choroby endokrynologiczne itp. Dziedziczne zaburzenia metaboliczne |
Żywienie (niedożywienie ilościowe i jakościowe, wczesne żywienie sztuczne niedostosowanymi mieszankami mlecznymi, nieprawidłowe i przedwczesne wprowadzanie pokarmów uzupełniających, nieprawidłowości w żywieniu i wady pielęgnacyjne) Przewlekły przebieg chorób żywieniowozależnych (niedokrwistość, krzywica, dysbioza jelitowa itp.) Ciężkie choroby zakaźne Ciężka przewlekła patologia |
Diagnostyka
Do identyfikacji niedożywienia u dzieci stosuje się metody kliniczne i laboratoryjne (tab. 25).
Tabela 25. Metody oceny stanu odżywienia
Metody somatometryczne są kluczową metodą oceny stanu odżywienia dziecka. Niezbędnym elementem antropometrii jest obecność tabel porównujących wskaźniki masy ciała i wieku i/lub mapy rozkładu centylowego wskaźników masy i wzrostu. W 2006 roku Światowa Organizacja Zdrowia zaproponowała „Standardowe wykresy wzrostu” dla dzieci ze wszystkich grup wiekowych do stosowania w ogólnej praktyce pediatrycznej. Mapy te zawierają rozkład dzieci według masy ciała, wzrostu i wieku, wskaźników masy ciała i wskaźnika masy ciała.
Pediatrzy domowi klasyfikują niedożywienie ze względu na czas jego wystąpienia oraz niedobór masy ciała (tab. 26).
Tabela 26. Klasyfikacja niedożywienia (wg E.V. Neudakhin, 2001)
Bardziej obiektywnym wskaźnikiem stanu rozwoju fizycznego dziecka w pewnym wieku jest uwzględnienie nie tylko masy ciała, ale także wzrostu. W tym celu zaleca się stosowanie tabel centylowych. Łączony niedobór masy i wzrostu ciała rozwija się przy długotrwałym niedożywieniu lub ciężkiej, przewlekłej chorobie dziecka.
W badaniach epidemiologicznych częstości występowania niedożywienia u dzieci wykorzystuje się wskaźnik Z-score, czyli odchylenie wartości pojedynczego wskaźnika (masa ciała, wzrost, BMI) od średniej wartości dla danej populacji podzielonej poprzez odchylenie standardowe wartości średniej.
W standardowej populacji średni wynik Z wynosi zero, a odchylenie standardowe wynosi 1,0. Dodatnie wartości Z-score wskazują na wzrost wskaźnika antropometrycznego w porównaniu do normy, a wartości ujemne wskazują na spadek parametrów w porównaniu do wartości standardowej. Dzięki wyraźnym wartościom ujemnym można ocenić opóźnienie w rozwoju fizycznym. Przykładowo 3-miesięczne dziecko ma masę ciała 4 kg, podczas gdy średnia masa ciała dziecka w tym wieku to 6 kg.
Prędkość Z = (4 - 6)/1
Zgodnie ze wzorem jego wynik Z wynosi -2, co wskazuje na znaczne opóźnienie w rozwoju fizycznym.
Złe odżywianie i utrata masy ciała objawiają się nie tylko niedoborem białkowo-kalorycznym, ale także hipowitaminozą, niedoborem wielu niezbędnych mikroelementów odpowiedzialnych za realizację funkcji odpornościowych, optymalny wzrost i rozwój mózgu. Dlatego długotrwałemu niedożywieniu często towarzyszy opóźnienie w rozwoju psychomotorycznym, opóźniona mowa oraz zdolności i funkcji poznawczych, a także duża częstość występowania chorób zakaźnych na skutek obniżonej odporności, co z kolei pogłębia zaburzenia odżywiania.
Przyczyny niedożywienia w różnych chorobach u dzieci można podzielić na 4 grupy:
niewystarczające i niezbilansowane odżywianie, naruszenie reżimu żywienia;
niedożywienie spowodowane trudnościami w jedzeniu: ciężka choroba, dysfagia, wymioty, porażenie mózgowe i inne;
zwiększone potrzeby żywieniowe: wcześniaki, wrodzone wady serca, przewlekła patologia płuc (dysplazja oskrzelowo-płucna, mukowiscydoza), okres rehabilitacji po ciężkich infekcjach, którym towarzyszy stres kataboliczny i inne.
zaburzenia trawienia i wchłaniania pokarmu: zespół złego wchłaniania, wszelkiego rodzaju uszkodzenia przewodu żołądkowo-jelitowego (po operacjach, choroby zapalne jelit, zespół utraty białka jelitowego itp.)
Korekta dietetyczna niedożywienia
Podstawowe zasady organizacji żywienia terapeutycznego w przypadku niedożywienia:
należy wziąć pod uwagę wiek, ciężkość, ciężkość i charakter choroby podstawowej;
dążyć do zaspokojenia związanego z wiekiem zapotrzebowania dziecka na podstawowe składniki odżywcze, energię, makro- i mikroelementy poprzez stopniowe zwiększanie dawki pokarmowej, biorąc pod uwagę tolerancję pokarmową dziecka;
unikać nieuzasadnionego zastępowania mleka kobiecego lub dostosowanych preparatów mlecznych produktami uzupełniającymi;
konsekwentnie wprowadzaj produkty do żywienia uzupełniającego, uwzględniając stan odżywienia dziecka, stopniowo zwiększając ich objętość;
stosuj produkowane na skalę przemysłową produkty paszowe uzupełniające; jako pierwszą dietę uzupełniającą zaleca się wprowadzenie zbóż.
W przypadku niedożywienia pierwszego stopnia konieczne jest ustalenie ogólnego reżimu, opieka nad dzieckiem i wyeliminowanie wad żywieniowych. W przepisach żywienia należy preferować mleko matki, a w przypadku karmienia mieszanego i sztucznego – dostosowane preparaty mleczne wzbogacone o galakto- i fruktooligosacharydy, które korzystnie wpływają na procesy trawienne i normalizację składu pokarmu. mikroflora jelitowa; nukleotydy, które poprawiają wchłanianie składników odżywczych i stymulują układ odpornościowy dziecka, a także fermentowane produkty mleczne. W tym przypadku obliczenia i korektę żywieniową przeprowadza się w oparciu o prawidłową masę ciała, na którą składa się masa ciała w chwili urodzenia oraz suma jej prawidłowych przyrostów w ciągu życia. Aby zwiększyć wartość energetyczną diety i zwiększyć zawartość białka, można przepisywać posiłki i pokarmy uzupełniające (kaszki, przeciery warzywno-mięsne, twarogi) 2 tygodnie wcześniej niż dzieciom zdrowym.
W przypadku niedożywienia drugiego stopnia korektę diety umownie dzieli się na trzy okresy: okres adaptacyjny (określający tolerancję pokarmową), okres naprawczy (pośredni) i okres wzmożonego odżywiania.
W okresie adaptacyjnym, który trwa 2-5 dni, żywienie oblicza się na podstawie rzeczywistej masy ciała, zgodnie z fizjologicznym zapotrzebowaniem dziecka na podstawowe składniki odżywcze i energię. Liczbę karmień zwiększa się o 1-2 dziennie, odpowiednio zmniejszając objętość każdego karmienia, podaje się dodatkowy płyn (5% roztwory glukozy lub soli fizjologicznej do nawodnienia jamy ustnej). W tym okresie, obok mleka matki lub odżywki dla niemowląt wzbogaconej o oligosacharydy i nukleotydy, wskazane jest stosowanie mieszanek na bazie hydrolizatu białek, które są łatwo trawione i wchłaniane przez organizm dziecka, oraz dostosowanych mieszanek mleka fermentowanego.
Przy normalnej tolerancji przepisanego żywienia objętość karmienia stopniowo (w ciągu 5–7 dni) zwiększa się do normy fizjologicznej. Można stosować preparaty o większej zawartości białka, np. specjalistyczne preparaty mleczne dla wcześniaków. Przy wystarczającym tempie przyrostu masy ciała i braku objawów dyspeptycznych obliczenia żywieniowe można przeprowadzić na podstawie prawidłowej masy ciała (masa ciała przy urodzeniu + jej normalny przyrost w ciągu życia), w pierwszej kolejności składników węglowodanowo-białkowych, a dopiero na końcu tłuszczowy składnik diety.
W okresie naprawczym można wprowadzać żywność uzupełniającą, zaczynając od zbóż produkowanych przemysłowo, a następnie wprowadzając mięso, twarożek i żółtko. W tym okresie należy przepisać preparaty enzymatyczne, kompleksy multiwitaminowe i środki pozytywnie wpływające na procesy metaboliczne.
W trakcie leczenia dzieci z niedożywieniem konieczna jest systematyczna rejestracja rzeczywistego odżywiania z wyliczeniem składu chemicznego codziennej diety na podstawie głównych składników pokarmowych.
W przypadku niedożywienia III stopnia wszystkie rodzaje metabolizmu ulegają gwałtownemu zakłóceniu, stan dziecka z reguły jest bardzo ciężki, dlatego takie dzieci wymagają intensywnej terapii, a często także stosowania nie tylko żywienia dojelitowego, ale także pozajelitowego, co wymaga hospitalizacji leczenie. Hipotrofia III stopnia spowodowana czynnikami żywieniowymi jest rzadka, ponieważ główne zaburzenia w żywieniu dziecka są wykrywane wcześnie i konieczna korekta dietetyczna diety tych dzieci jest prowadzona nawet przy I - II stopniu niedożywienia.
Taktyka postępowania z pacjentami z niedożywieniem III stopnia
Istnieje kilka głównych kroków taktycznych w leczeniu ciężkiego niedożywienia w początkowym okresie:
leczenie lub zapobieganie hipoglikemii i hipotermii,
leczenie lub zapobieganie odwodnieniu i przywracanie równowagi elektrolitowej,
leczenie etiotropowe procesu zakaźnego, jeśli występuje,
identyfikowanie i przezwyciężanie innych problemów związanych z niedoborami witamin, mikroelementów, anemią itp.
W przypadku dzieci, które nie wymagają pilnej terapii, podstawą odpowiedniego wsparcia żywieniowego jest optymalne żywienie. Aby uniknąć nadmiernego obciążenia przewodu pokarmowego, nerek i wątroby, odżywianie należy rozpoczynać od małych porcji z krótkimi przerwami między posiłkami (2,5-3 godz.), jeśli dziecko je samodzielnie i utrzymuje apetyt. Pojemność energetyczna diety powinna zapewniać co najmniej 80 kcal/kg i nie więcej niż 100 kcal/kg/dzień. Przy niższym spożyciu kalorii procesy kataboliczne trwają, natomiast przy większym spożyciu kalorii mogą rozwinąć się poważne zaburzenia metaboliczne. W miarę przyzwyczajania się dziecka do tej zawartości kalorii stopniowo zwiększa się ilość pokarmu, ilość białka i odstępy między karmieniami. Ilość białka w diecie w pierwszych dniach karmienia należy zmniejszyć do 1,0-1,2 g/100 ml mieszanki (tab. 27).
|
Składniki odżywcze |
Ilość na kg masy ciała/dzień |
|
Elektrolity: |
|
|
Mikroelementy: |
|
|
Witaminy rozpuszczalne w wodzie: Nikotiamid Kwas foliowy Kwas pantotenowy |
|
|
Witaminy rozpuszczalne w tłuszczach |
|
W przypadku dzieci z zaburzeniami funkcji trawiennej i wchłaniania jelit (zespół krótkiego jelita, uporczywa biegunka, nieswoiste zapalenie jelit) żywienie dojelitowe należy rozpocząć od bardzo niskiego stężenia produktu, lepiej stosować mieszanki zawierające hydrolizowane białko, zaczynając od Stężenie produktu 3%. Stosowanie mieszanin zawierających składnik białkowy rozdzielony na peptydy (Alfare, Nutrilon Pepti TSC, Nutrilak Peptidi SCT, Pregestimil) nie wymaga aktywnej pracy proteaz i pozwala na odpowiednią podaż białka do procesów naprawczych. Stężenie podawanej mieszaniny zwiększa się powoli, zwiększając się o 1% dziennie (tab. 28).
Tabela 28. Stężenia mieszaniny na bazie hydrolizatu białkowego stosowanej u dzieci z ciężkim niedożywieniem III stopnia
Następnie stężenie mieszaniny stopniowo zwiększa się do 13,5%, a jeśli jest dobrze tolerowane - do 15%. Braki kalorii, elektrolitów i składników odżywczych w okresie spożywania produktu o niskim stężeniu składników odżywczych uzupełniane są żywieniem pozajelitowym. W przypadku ciężko chorych dzieci wskazany jest powolny, ciągły wlew mieszanek odżywczych przez zgłębnik nosowo-żołądkowy, co sprzyja optymalnemu wykorzystaniu składników odżywczych. Zmieniając szybkość infuzji, można stopniowo zwiększać objętość trawienia w jamie ustnej i wchłanianie jelitowe. Ta metoda karmienia jest skuteczna i logiczna w przypadku dzieci o zmniejszonej powierzchni wchłaniania, takich jak zanik kosmków jelitowych, zespół krótkiego jelita i inne schorzenia.
Przejście na frakcyjne żywienie dojelitowe może trwać od kilku dni do kilku tygodni, a nawet miesięcy, w zależności od ciężkości stanu pacjenta i skuteczności ciągłego wlewu. W okresie infuzji należy jednocześnie stymulować ssanie i połykanie. Przechodząc na posiłki podzielone, można najpierw pozostawić stały napar na noc z jednoczesnymi posiłkami podzielonymi w ciągu dnia w małych porcjach 5 - 6 razy w ciągu dnia, aż kaloryczność posiłków podzielonych nie przekroczy 75% dziennego spożycia. Od tego momentu całkowicie przechodzą na żywienie frakcyjne, jednak spożycie doustne należy zwiększać bardzo powoli, ponieważ odżywianiu infuzyjnemu towarzyszy względne zmniejszenie aktywności jelit.
Poprawa apetytu dziecka i pojawienie się przyrostu masy ciała wskazują na poprawę stanu dziecka. Od tego momentu rozpoczyna się faza rehabilitacji, w której następuje stopniowe przechodzenie na dietę bardziej kaloryczną i bogatszą w białko, a także zastępowanie mieszanek hydrolizowanych mieszankami zawierającymi pełnowartościowe białko. Objętość karmienia frakcyjnego należy powoli zwiększać o 10 ml przy każdym kolejnym karmieniu (na przykład 60 ml, następnie 70 ml, następnie 80 ml itd.), aż objętość żywienia osiągnie normę wiekową.
W tym okresie należy prowadzić dla dziecka kartę żywieniową, zapisując przepisane i faktycznie spożywane posiłki. W okresie rehabilitacji ładunek energetyczny stopniowo wzrasta od 80 - 100 kcal/kg/dzień do 130 kcal/kg/dzień przy maksymalnym spożyciu do 150 - 200 kcal/kg/dzień. Jeśli dziecko nie jest w stanie strawić dawki odżywczej wynoszącej 130 kcal/kg/dzień, należy powrócić do mniejszych objętości, większej częstotliwości, a nawet, jeśli to konieczne, ciągłych wlewów roztworów odżywczych. Czas trwania rehabilitacji zależy od wieku, ciężkości choroby podstawowej i szybkości przystosowania się dziecka do żywienia. Jednocześnie zwiększaj ilość białka w diecie od 1 do 2,5 – 3,0 g/100 ml. Kryteriami adekwatności wsparcia żywieniowego są: poprawa apetytu, ogólne samopoczucie, aktywność fizyczna oraz dobowy przyrost masy ciała o co najmniej 5 g/kg masy ciała na dobę.
Materiały do tego rozdziału udostępnili także: Bushueva T.V. (Moskwa), Rybakova E.P. (Moskwa), Stepanova T.N. (Moskwa)
RCHR (Republikańskie Centrum Rozwoju Zdrowia Ministerstwa Zdrowia Republiki Kazachstanu)
Wersja: Protokoły kliniczne Ministerstwa Zdrowia Republiki Kazachstanu – 2015
Marazm żywieniowy (E41), Niedożywienie białkowo-energetyczne, nieokreślone (E46), Umiarkowane i łagodne niedożywienie białkowo-energetyczne (E44), Opóźnienie rozwoju spowodowane niedożywieniem białkowo-energetycznym (E45), Kwashiorkor (E40), Kwashiorkor marazmowy (E42), Ciężkie niedożywienie białkowo-energetyczne, nieokreślone (E43)
Gastroenterologia dziecięca, pediatria
informacje ogólne
Krótki opis
Zalecana
Porada eksperta
RSE w RVC „Centrum Republikańskie”
rozwój opieki zdrowotnej”
Ministerstwo Zdrowia
i rozwój społeczny
Republika Kazachstanu
z dnia 6 listopada 2015 r
Protokół nr 15
Nazwa protokołu: Niedobory białkowo-energetyczne u dzieci
Niedobór białka i energii- niedożywienie dziecka, które charakteryzuje się zatrzymaniem lub spowolnieniem przyrostu masy ciała, postępującym ubytkiem tkanki podskórnej, zaburzeniami proporcji ciała, funkcji odżywczych, metabolizmu, osłabieniem swoistych, nieswoistych mechanizmów obronnych i osłabieniem organizmu, skłonność do rozwoju innych chorób, opóźnienia w rozwoju fizycznym i neurologicznym, rozwój umysłowy.
Kod protokołu:
Kody ICD-10:
· E40-E 46. Niedożywienie (hipotrofia: prenatalna, poporodowa).
· E40. Kwashiorkor.
· E41. Odżywcze szaleństwo.
· E42. Starczy kwashiorkor.
· E43. Ciężkie niedożywienie białkowo-energetyczne, nieokreślone.
· E44. Niedożywienie białkowo-energetyczne, nieokreślone, umiarkowane i słabe.
· E45. Opóźnienie rozwoju spowodowane niedoborem białkowo-energetycznym.
· E46. Niedożywienie białkowo-energetyczne, nieokreślone.
Skróty stosowane w protokole:
|
PEM - niedożywienie białkowo-energetyczne ACTH - hormon adrenkortykotropowy AMK – aminokwas AST - aminotransferaza asparaginianowa ALT- aminotransferaza alaninowa AT do TTG - przeciwciała przeciwko transglutaminazie tkankowej Nieswoiste zapalenie jelit – choroby zapalne jelit VPR - wrodzona wada UPS - Wrodzona wada serca GERD - choroba refluksowa przełyku Przewód pokarmowy - przewód pokarmowy BMI - wskaźnik masy ciała CT - tomografia komputerowa KFK- fosfokinaza kreatynowa Terapia ruchowa - fizjoterapia CF - mukowiscydoza NS - układ nerwowy PP - żywienie pozajelitowe SCT - średniołańcuchowe trójglicerydy 17-OX – 17-ketosteroidy TSH - hormon tyreotropowy USG - ultrasonografia FGDS - fibroesofagogastroduodenoskopia alkaliczny fosforan - fosfatazy alkalicznej OUN - ośrodkowy układ nerwowy EKG - elektrokardiogram EchoCG - Echokardiografia |
Data opracowania protokołu: 2015
Użytkownicy protokołu: pediatrzy, lekarze pierwszego kontaktu, neurolodzy dziecięcy, gastroenterolodzy, endokrynolodzy, chirurdzy, onkolodzy, hematolodzy, pulmonolodzy, resuscytatorzy.
Ocena stopnia udokumentowania przedstawionych zaleceń.
Skala poziomu dowodu:
| A | Wysokiej jakości metaanaliza, systematyczny przegląd badań RCT lub duże badania RCT z bardzo niskim prawdopodobieństwem (++) błędu systematycznego, których wyniki można uogólnić na odpowiednią populację. |
| W | Wysokiej jakości (++) systematyczny przegląd badań kohortowych lub kliniczno-kontrolnych lub wysokiej jakości (++) badań kohortowych lub kliniczno-kontrolnych o bardzo niskim ryzyku błędu systematycznego lub RCT o niskim (+) ryzyku błędu systematycznego, wyniki które można uogólnić na odpowiednią populację. |
| Z |
Badanie kohortowe lub kliniczno-kontrolne lub badanie kontrolowane bez randomizacji z niskim ryzykiem błędu systematycznego (+). Wyniki, które można uogólnić na odpowiednią populację lub RCT z bardzo niskim lub niskim ryzykiem błędu systematycznego (++ lub +), których wyników nie można bezpośrednio uogólnić na odpowiednią populację. |
| D | Seria przypadków lub niekontrolowane badanie lub opinia eksperta. |
| GPP | Najlepsza praktyka farmaceutyczna. |
Klasyfikacja
Klasyfikacja kliniczna:
Według czasu wystąpienia:
· prenatalny;
· poporodowy.
Według etiologii:
· żywieniowy;
· zakaźny;
· związane z wadami diety i żywienia;
· związane z czynnikami uszkadzającymi okres prenatalny;
· spowodowane patologią dziedziczną i wrodzonymi anomaliami rozwojowymi.
Według wagi:
· Stopień PEM I – niedobór masy ciała 11-20%;
· PEM II stopień – niedobór masy ciała 21-30%;
· PEM III stopień – niedobór masy ciała › 30%.
Według okresów:
· wstępny;
· progresja;
· stabilizacja;
· rekonwalescencja.
Według formularza:
Ostry – objawiający się dominującym ubytkiem masy ciała i jej niedoborem w stosunku do wymaganej masy ciała dla wzrostu;
· przewlekła – objawiająca się nie tylko brakiem masy ciała, ale także znacznym opóźnieniem wzrostu.
Niektóre specjalne warianty odmiany BEN:
· kwashiorkor, marazm odżywczy, kwashiorkor marazmowy;
· niedożywienie u starszych dzieci;
· brak mikroelementów (miedź, cynk, selen).
Obraz kliniczny
Objawy, oczywiście
Kryteria diagnostyczne diagnozy
:
Reklamacje i wywiad:
Uskarżanie się: w zależności od patologii, która doprowadziła do oznak niedożywienia: słaby przyrost masy ciała i wzrostu, słaby apetyt, odmowa jedzenia, wymioty, nudności, dławienie się podczas karmienia, wzdęcia, luźne stolce, zaparcia, duża objętość stolca, ból brzucha, obrzęk, skurcze , kaszel, duszność, długotrwała gorączka, stany lękowe, suchość skóry, wypadanie włosów, deformacja paznokci, osłabienie.
Anamneza: Określ chorobę u dziecka, która doprowadziła do objawów PEM.
Tabela 1 – Główne przyczyny niedożywienia u dzieci
| powoduje | mechanizmy | nozologie i warunki |
| Niewystarczające spożycie pokarmu | zaburzenia połykania (dysfagia), anoreksja, zaburzenia świadomości, krwotok śródczaszkowy, przewlekła niewydolność serca lub oddechowa, niedożywienie, niedożywienie u młodzieży | niezamykanie podniebienia miękkiego i twardego, nowotwory jamy ustnej i gardła, zaburzenia anatomiczne przewodu pokarmowego (refluks żołądkowo-przełykowy, skurcz odźwiernika, zwężenie odźwiernika), wrodzone wady serca, wrodzone wady rozwojowe płuc, wrodzone wady rozwojowe układu nerwowego, zespół nadnerczowo-płciowy, anoreksja psychogenna |
| Zaburzenia trawienia i wchłaniania składników odżywczych (złe trawienie i wchłanianie) | zaburzenia trawienia i wchłaniania białek, tłuszczów, węglowodanów, mikromakroelementów | mukowiscydoza, celiakia, enteropatyczne zapalenie akrodermii, enteropatie alergiczne, zaburzenia transportu glukozy – galaktozy, stany niedoborów odporności, zespół krótkiego jelita, limfangiektazje, biegunka chlorkowa, wrodzona wada rozwojowa jelita cienkiego i grubego |
| Utrata składników odżywczych z organizmu | utrata białek, witamin, makro i mikroelementów – przez przewód pokarmowy lub nerki | przetoki jelitowe, obfita biegunka, niekontrolowane wymioty, zespół Barttera, IBD |
| Zaburzenia metaboliczne | stany kataboliczne, dysfunkcje narządów | ciężkie urazy, posocznica, proces onkologiczny, białaczka, wątroba, niewydolność nerek |
Kryteria kliniczne:
· ocena stanu fizycznego (zgodność z normami wiekowymi dotyczącymi masy ciała, długości ciała itp.) z wykorzystaniem tabel centylowych;
· ocena stanu somatycznego i emocjonalnego (żywotność, reakcja na środowisko, zachorowalność itp.);
· ocena skóry (bladość, suchość, obecność wysypek itp.);
· ocena stanu błon śluzowych (obecność aft, drozdów itp.);
· ocena turgoru tkanek;
Właściwą (idealną) masę ciała u dzieci określa się za pomocą tabel centylowych lub percentylowych rozkładów masy ciała w zależności od wzrostu, wieku i płci dziecka. Podczas badania parametrów antropometrycznych u dzieci ocenia się obwód głowy, klatki piersiowej, brzucha, barków, bioder, a także grubość fałdów skórnych i tłuszczowych w standardowych punktach. U małych dzieci duże znaczenie przywiązuje się do obwodu głowy, liczby zębów i wielkości ciemiączków.
Tabela 2 – Klasyfikacja niedożywienia białkowo-energetycznego u małych dzieci (wg Waterlow J.C., 1992)
Tabela 3 - Ocena stanu odżywienia dzieci powyżej 12. roku życia według wskaźnika masy ciała (Gurova M.M., Khmelevskaya I.G., 2003)
| Rodzaj zaburzeń odżywiania | stopień | Wskaźnik masy ciała |
| Otyłość | I | 27,5-29,9 |
| II | 30-40 | |
| III | >40 | |
| Zwiększone odżywianie | 23,0-27,4 | |
| Norma | 19,5-22,9 | |
| Zmniejszone odżywianie | 18,5-19,4 | |
| BEN | I | 17-18,4 |
| II | 15-16,9 | |
| III | <15 |
Ocena podskórnej warstwy tłuszczu (zmniejszenie lub brak):
· przy I etapie PEN – redukcja na brzuchu;
· w stopniu PEN II – zmniejszenie brzucha, kończyn;
· z III stopniem PEN – brak na twarzy, brzuchu, tułowiu i kończynach.
Badanie fizykalne i laboratoryjne: opóźniony rozwój fizyczny i neuropsychiczny.
BEN I stopień- nie zawsze jest diagnozowany, ponieważ ogólny stan dziecka niewiele cierpi. Objawy: umiarkowany niepokój ruchowy, spowolnienie wypróżnień, lekka bladość skóry, zmniejszenie podskórnej tkanki tłuszczowej w tułowiu i/lub brzuchu. W okolicy pępka podskórna warstwa tłuszczu osiąga 0,8 - 1,0 cm, masa ciała zmniejsza się o 10-20% w stosunku do normalnej wartości. BMI - 17 - 18,4. Wskaźnik stanu ciała Chulitskiej sięga 10-15 (zwykle 20-25). Rozwój psychomotoryczny odpowiada wiekowi, reaktywność immunologiczna i tolerancja pokarmowa nie ulegają zmianie. W spektrum białek krwi występuje hipoalbuminemia. Objawy krzywicy, niedokrwistość z niedoboru.
BENII stopień- charakteryzuje się wyraźnymi zmianami we wszystkich narządach i układach. Zmniejszony apetyt, okresowe wymioty, zaburzenia snu. Występuje opóźnienie w rozwoju psychomotorycznym: dziecko nie trzyma dobrze głowy, nie siedzi, nie stoi na nogach i nie chodzi. Zaburzenia termoregulacji objawiają się znacznymi wahaniami temperatury ciała w ciągu dnia. Ostre zmniejszenie tkanki tłuszczowej podskórnej na brzuchu, tułowiu i kończynach. Fałd skórny w okolicy pępka wynosi 0,4-0,5 cm, wskaźnik Chulitskaya spada do 10,0. Różnica w masie wynosi 20-30%, długość ciała 2-4 cm, BMI 15-16,9. Nieprawidłowy typ krzywej wzrostu masy. Skóra jest blada, jasnoszara, obserwuje się suchość i łuszczenie się skóry (objawy poliwitaminozy). Zmniejsza się elastyczność, turgor tkanek i napięcie mięśni. Włosy są matowe i łamliwe. Zmniejsza się tolerancja pokarmowa. Zmienia się charakter wypróżnień - niestabilne stolce, naprzemienne zaparcia i biegunka. W kale można wykryć skrobię, tłuszcz obojętny, śluz, włókna mięśniowe i zaburzenia flory jelitowej. Mocz ma zapach amoniaku. Współistniejące patologie somatyczne (zapalenie płuc, zapalenie ucha środkowego, odmiedniczkowe zapalenie nerek), stany niedoborowe.
BENIII stopień- anoreksja, ogólny letarg, zmniejszone zainteresowanie otoczeniem, brak aktywnych ruchów. Twarz jest cierpiąca, starcza, policzki zapadnięte z zanikiem grudek Bishy, w okresie terminalnym – obojętność. Termoregulacja jest poważnie upośledzona, dziecko szybko się ochładza. Fałd skóry na wysokości pępka do 0,2 cm (prawie zanika). Wskaźnik stanu ciała Chulitskiej jest ujemny. Opóźnienie w masie ciała przekracza 30%, opóźnienie w długości ciała przekracza 4 cm, opóźniony rozwój psychomotoryczny. BMI -<15 Дыхание поверхностное, иногда могут отмечаться апноэ. Тоны сердца ослабленные, глухие, может наблюдаться тенденция к брадикардии, артериальной гипотонии. Живот увеличен в объёме вследствие метеоризма, передняя брюшная стенка истончена, контурируются петли кишок, запоры чередуются с мыльно-известковыми испражнениями. Резко нарушена толерантность к пище, нарушены все виды обмена. У большинства больных отмечается рахит, анемия, явления дисбиоза. Терминальный период характеризуется триадой: гипотермией (температура тела 32-33° С), брадикардией (60-49 уд/мин), гипогликемией.
Objawy kliniczne PEM można podzielić na zespoły:
· zespół zaburzeń troficznych: ścieńczenie podskórnej tkanki tłuszczowej, zmniejszenie turgoru tkanek, spłaszczenie krzywej wzrostu i niedobór masy ciała w stosunku do długości ciała, objawy poliwitaminozy i hipomikroelementozy;
· zespół zaburzeń trawiennych: anoreksja, zaburzenia dyspeptyczne, obniżona tolerancja pokarmowa, objawy złego trawienia w coprogramie;
· zespół dysfunkcji ośrodkowego układu nerwowego: obniżony napięcie emocjonalne, przewaga emocji negatywnych, okresowy stan lękowy (z III stopniem PEN – apatia), opóźniony rozwój psychoruchowy;
· zespół zaburzeń hematopoezy i obniżonej reaktywności immunobiologicznej: niedokrwistość niedoborowa, wtórne stany niedoborów odporności (szczególnie dotknięty jest komórkowy składnik odporności). Odnotowuje się wymazany, nietypowy przebieg procesów patologicznych.
Diagnostyka
Testy diagnostyczne:
Podstawowe (obowiązkowe) badania diagnostyczne wykonywane w warunkach ambulatoryjnych:
· ogólna analiza krwi;
· ogólna analiza moczu;
· współprogram;
· biochemiczne badanie krwi: białko całkowite, bilirubina całkowita i jej frakcje, ALT, AST, glukoza;
Ważenie i mierzenie długości ciała dziecka
Minimalny wykaz badań, które należy wykonać w przypadku skierowania na planową hospitalizację: zgodnie z regulaminem wewnętrznym szpitala, z uwzględnieniem aktualnego zarządzenia uprawnionego organu w zakresie opieki zdrowotnej.
Podstawowe (obowiązkowe) badania diagnostyczne przeprowadzane w warunkach szpitalnych (w trakcie planowanej hospitalizacji):
· ogólne badanie krwi (raz na 10 dni);
· ogólna analiza moczu (raz na 10 dni);
· biochemiczne badanie krwi: białko całkowite, frakcje białkowe, bilirubina całkowita i jej frakcje, ALT, AST, glukoza, fosfataza zasadowa, poziom elektrolitów (potas, sód, magnez, fosfor, wapń, chlor), mocznik, transferyna, kreatynina, cholesterol;
· współprogram;
· EKG;
· EchoCG;
· USG narządów jamy brzusznej, nerek, nadnerczy;
· monitorowanie i analiza aktualnego żywienia – codziennie;
Wykonano dodatkowe badania diagnostycznena poziomie stacjonarnym:
· oznaczanie chlorków w pocie;
· oznaczenie przeciwciał przeciwko transglutaminazie tkankowej (AT do TTG) testem „Biocard celiakia”;
· wysiew płynów biologicznych z selekcją kolonii;
· analiza wrażliwości drobnoustrojów na antybiotyki;
· koagulogram;
· immunogram (liczba całkowita limfocytów, limfocyty T CD4+, granulocyty, aktywność dopełniacza, immunoglobuliny A, M, G);
· hormony tarczycy (TSH, T3, T4), nadnerczy (kortyzol, ACTH, 17 OCS), CPK;
· FGDS z biopsją;
· badanie histologiczne błony śluzowej jelita czczego;
· CT (głowa, klatka piersiowa, jama brzuszna, narządy miednicy);
codzienne wydalanie soli;
· badania genetyczne (zgodnie z zaleceniami genetyka);
· Badanie RTG klatki piersiowej i narządów jamy brzusznej;
· konsultacje specjalistów: pulmonologa, gastroenterologa, immunologa,
onkolog, neurolog, hematolog, endokrynolog, psycholog medyczny, psychiatra, chirurg, kardiochirurg, specjalista chorób zakaźnych, genetyk, dietetyk, resuscytator.
Studia instrumentalne:
· EKG – do diagnostyki przesiewowej;
· EchoCG – w celach diagnostycznych w celu identyfikacji zmian morfologicznych i czynnościowych w sercu;
· badanie USG jamy brzusznej, nerek – w diagnostyce przesiewowej.
· Fibroesofagogastroduodenoskopię z biopsją jelita cienkiego wykonuje się w celach diagnostycznych u dzieci z zespołem złego wchłaniania.
· Fibroesofagogastroduodenoskopię wykonuje się w celach diagnostycznych u dzieci z niedomykalnością lub wymiotami.
· Badanie RTG przełyku, żołądka, dróg żółciowych, jelit, płuc – w celu wykluczenia wad wrodzonych.
· Tomografia komputerowa głowy, klatki piersiowej, jamy brzusznej, narządów miednicy - w celu wykluczenia procesu patologicznego.
Badania laboratoryjne:
· oznaczenie chlorków w pocie – w przypadku podejrzenia mukowiscydozy;
· oznaczenie przeciwciał przeciwko transglutaminazie tkankowej (AT do TTG) testem „Biocard celiakia” – w przypadku zaburzeń wchłaniania w celu wykluczenia celiakii;
· wysiew płynów biologicznych z selekcją rodzin – w trakcie długotrwałego procesu infekcyjnego;
· analiza wrażliwości drobnoustrojów na antybiotyki – w celu doboru racjonalnej terapii przeciwdrobnoustrojowej;
· koagulogram – do diagnostyki układu hemostazy;
· immunogram (liczba całkowita limfocytów, limfocyty T CD4+, granulocyty, aktywność dopełniacza, immunoglobuliny A, M, G) – w celu wykluczenia stanu niedoboru odporności;
· hormony tarczycy (TSH, T3, T4), nadnerczy (kortyzol, ACTH, 17 OKS), CPK – w celu wykluczenia patologii tarczycy i nadnerczy;
codzienne wydalanie soli - w diagnostyce zaburzeń metabolicznych.
Diagnostyka różnicowa
Diagnostyka różnicowa:
Podczas badania i badania dziecka z PEM ustala się przyczynę, która doprowadziła do PEM i wyklucza konkurencyjną patologię.
W związku z tym konieczne jest rozróżnienie następujących chorób:
· choroba zakaźna;
· przewlekłe choroby układu oskrzelowo-płucnego;
· enzymopatie dziedziczne i wrodzone;
· choroby endokrynologiczne;
choroby organiczne centralnego układu nerwowego;
· choroby chirurgiczne;
· choroby genetyczne;
· choroby przebiegające z zespołem złego wchłaniania;
· patologia onkologiczna.
Leczenie za granicą
Skorzystaj z leczenia w Korei, Izraelu, Niemczech i USA
Uzyskaj poradę dotyczącą turystyki medycznej
Leczenie
Cele leczenia:
· eliminacja czynników, które doprowadziły do PEM;
· stabilizacja stanu dziecka;
· zoptymalizowana dieta terapeutyczna;
· terapia zastępcza (enzymy, witaminy, mikroelementy);
· przywrócenie obniżonego stanu odporności;
· leczenie chorób współistniejących i powikłań;
· organizacja optymalnego schematu, pielęgnacji, masażu, terapii ruchowej;
Taktyka leczenia:
· dzieci z PEM w I stopniu zaawansowania, przy braku ciężkich chorób współistniejących i powikłań, są wskazane do leczenia ambulatoryjnego;
· dzieci z PEM II – III stopniem, w zależności od ciężkości stanu, kierowane są do badań stacjonarnych i leczenia;
· w leczeniu dzieci z PEN III stopnia, z objawami niewydolności wielonarządowej, w celu korekty prowadzonej terapii infuzyjnej i żywienia pozajelitowego, hospitalizacji na oddziale intensywnej terapii;
· Leczenie PEM u starszych dzieci obejmuje te same ogólne zasady, co w leczeniu PEM u małych dzieci. W przypadku dzieci w wieku szkolnym dopuszczalna jest dieta stosowana w PEM u osób dorosłych, jednak uwzględniająca związane z wiekiem zapotrzebowanie na składniki odżywcze, składniki, kalorie oraz indywidualne cechy chorego dziecka.
Leczenie niefarmakologiczne:
· optymalny harmonogram snu, dostosowany do wieku, przebywaj w regularnie wentylowanym, jasnym pomieszczeniu, sprzątanie na mokro odbywa się 2 razy dziennie. W pomieszczeniu (oddziale) należy utrzymywać temperaturę powietrza w granicach 25-26°C.
· dietoterapia: mieszanki na bazie głębokiej hydrolizy białek mleka, z MCT, bez laktozy, o wysokiej zawartości kalorii (Nutrilon Petit Gastro, Alfare, Humana HN MCT; dla dzieci powyżej pierwszego roku życia: Nutricomp Energy, Nutricomp Energy Fibre, Nutrien Elemental, Fresubin Energy, Diben, Reconvan, Nutrien Immun, Supportan, Pedia Shur Mieszanki dla wcześniaków na bazie częściowej hydrolizy białek, z MCT, wysokokaloryczne: Humana O-NA, Pre Nutrilon, Pre Nan, Similac Special Care;
Farmakoterapia:
Niezbędne leki (Tabela 8):
Preparaty enzymatyczne - leki poprawiające proces trawienia, zawierające enzymy trawienne (enzymy). Najbardziej optymalne są mikrosferyczne i mikrokapsułkowane formy pankreatyny. Preparaty enzymatyczne są przepisywane długoterminowo w ilości 1000 jednostek/kg dziennie w głównych posiłkach.
Witaminy rozpuszczalne w tłuszczach, rozpuszczalne w wodzie- do uzupełniania stanów niedoborowych (kwas askorbinowy, witaminy z grupy B, witamina A, E, D, K), do podawania pozajelitowego - Addamel, Vitalipid.
Antybiotyki - Do zapobiegania i leczenia infekcji stosuje się różne grupy antybiotyków .
Probiotyki -żywe mikroorganizmy, które stanowią normalną florę przewodu pokarmowego człowieka. U dzieci z PEM obserwuje się procesy dysbiotyczne. Przepisywane są preparaty probiotyczne - zawierające bakterie lakto i bifido (Bifiform, Lacidofil, Normobakt).
Suplementy żelaza - stosowany w PEM w celu uzupełnienia niedoboru żelaza (Totema, Aktiferrin, Ranferon).
Leki uzupełniające niedobór hormonów tarczycy zalecany przy niedoczynności tarczycy o różnej etiologii.
Glukokortykoidy mają wyraźne działanie przeciwzapalne, przeciwalergiczne, przeciwwstrząsowe, antytoksyczne.
Leki immunologiczne, stosowany w terapii zastępczej i immunomodulacyjnej. Zmniejszają ryzyko rozwoju infekcji przy pierwotnych i wtórnych niedoborach odporności, natomiast przeciwciała posiadają wszystkie właściwości charakterystyczne dla zdrowego człowieka i stosowane są jako terapia zastępcza u dzieci – Octagam 10%.
Leki zastępujące osocze przeznaczony do korekcji ciężkich zaburzeń metabolizmu białek (hipoproteinemia), przywrócenia ciśnienia koloidowo-onkotycznego, zaburzeń hemodynamiki - roztwór albuminy 5%, 10%, 20%).
Roztwory aminokwasów - specjalne rozwiązania żywieniowe do żywienia pozajelitowego dzieci, dla pacjentów z ostrą i przewlekłą niewydolnością nerek, pacjentów z różnymi chorobami wątroby oraz do leczenia encefalopatii wątrobowej. Roztwory infuzyjne składające się z elektrolitów i aminokwasów, które są analogami metabolicznymi lub substancjami fizjologicznymi do tworzenia białek. Zbilansowana zawartość aminokwasów egzogennych i egzogennych – Infezol 40, Infezol 100, Aminoplasmal E 5%, 10%, Aminoven infant 10%.
Emulsje tłuszczowe- stosowanie emulsji tłuszczowych dostarcza organizmowi wielonienasyconych kwasów tłuszczowych i pomaga chronić ścianę żył przed podrażnieniami roztworami hiperosmolarnymi. Źródło energii zawierające łatwo przyswajalny składnik lipidowy (triglicerydy średniołańcuchowe) – dostarczające organizmowi niezbędnych nienasyconych kwasów tłuszczowych w ramach żywienia pozajelitowego – Lipofundin MCT\LCT, Intralipid 20%, SMOFlipid 20%.
Roztwór glukozy- glukoza bierze udział w różnych procesach metabolicznych w organizmie, 5%, 10%, 20%.
Połączone leki - obejmują łączone pojemniki do podawania pozajelitowego: dwuskładnikowe „dwa w jednym” (roztwór AMK i roztwór glukozy), trójskładnikowe „trzy w jednym” (roztwór AMK, roztwór glukozy i emulsja tłuszczowa), także (roztwór AMK , roztwór glukozy, emulsja tłuszczowa z dodatkiem kwasów tłuszczowych omega 3) – Oliclinomel, SmofKabiven centralny, SMOF Kabiven peryferyjny.
Leczenie farmakologiczne świadczone w trybie ambulatoryjnym:
W przypadku PEM wynoszącego 1–2 stopnie tradycyjną terapię dietetyczną przeprowadza się ze stopniową zmianą diety, podkreślając:
· etap adaptacji, ostrożne, tolerancyjne żywienie;
· etap odżywiania reparacyjnego (pośredniego);
· etap żywienia optymalnego lub wzmocnionego.
W okresie ustalania się tolerancji pokarmowej dziecko dostosowuje się do wymaganej jej objętości oraz koryguje gospodarkę wodno-mineralną i białkową. W okresie regeneracyjnym następuje korekta metabolizmu białek, tłuszczów i węglowodanów, natomiast w okresie wzmożonego odżywiania zwiększa się ładunek energetyczny.
W przypadku PEM w początkowych okresach leczenia należy zmniejszyć objętość i zwiększyć częstotliwość karmienia. Wymagana dzienna ilość pokarmu dla niedożywionego dziecka wynosi 200 ml/kg, co stanowi 1/5 jego rzeczywistej masy ciała. Objętość płynu ograniczona jest do 130 ml/kg na dobę, a w przypadku ciężkich obrzęków – do 100 ml/kg na dobę.
Przy I etapie PEN okres adaptacyjny trwa zwykle 2-3 dni. Pierwszego dnia przepisuje się 2/3 wymaganej dziennej ilości pożywienia. W okresie ustalania tolerancji pokarmowej stopniowo zwiększa się jej objętość. Po osiągnięciu wymaganej dziennej ilości pożywienia zaleca się ulepszone odżywianie. W tym przypadku ilość białek, tłuszczów i węglowodanów wyliczana jest dla prawidłowej masy ciała (powiedzmy, że ilość tłuszczu wyliczana jest dla średniej masy ciała pomiędzy rzeczywistą a oczekiwaną).
Tabela 4 – Leczenie dietetyczne etapu 1 PEM
| liczba karmień | zawartość kalorii, kcal/kg/dzień | białka, g\kg\dzień | tłuszcze, g\kg\dzień | węglowodany\g\kg\dzień |
|
według wieku n = 5-6 (10) |
obliczenia według wieku i właściwej wagi Właściwa masa ciała = masa ciała przy urodzeniu + suma jej prawidłowych przyrostów w ciągu życia |
|||
| 0-3 miesiące 115 | 2,2 | 6,5 | 13 | |
| 4-6 miesięcy 115 | 2,6 | 6,0 | 13 | |
| 7-12 miesięcy 110 | 2,9 | 5,5 | 13 | |
W przypadku PEN II stopnia w pierwszym dniu podaje się 1/2-2/3 dziennej dawki pokarmu. Brakującą ilość pożywienia uzupełnia się poprzez przyjmowanie roztworów nawadniających. Okres adaptacyjny kończy się w momencie osiągnięcia wymaganej dziennej ilości pożywienia.
Tabela 5 – Obliczanie żywienia dla stopnia PEM II w okresie adaptacyjnym
Przy normalnej tolerancji rozpoczyna się okres regeneracyjny, kiedy to stopniowo (w ciągu 5-7 dni) zwiększa się objętość żywienia, a kalkulacja składników odżywczych odbywa się na podstawie prawidłowej masy ciała. W pierwszej kolejności zwiększa się zawartość węglowodanów i białek w diecie, a następnie tłuszczu. Staje się to możliwe dzięki wprowadzeniu pokarmów uzupełniających: płatków bezmlecznych, przecierów mięsnych i warzywnych.
Tabela 6 – Obliczanie żywienia dla etapu II PEN w okresie rekonwalescencji
W okresie wzmożonego odżywiania stopniowo zwiększa się zawartość białek i węglowodanów, ich ilość zaczyna się przeliczać na prawidłową masę ciała, ilość tłuszczu – na średnią wagę pomiędzy rzeczywistą a oczekiwaną. Jednocześnie ładunek energii i białka w rzeczywistej masie ciała przewyższa obciążenie u zdrowych dzieci. Wynika to ze znacznego wzrostu zużycia energii u dzieci w okresie rekonwalescencji po PEM.
Tabela 7 – Obliczanie żywienia dla etapu II PEN w okresie wzmożonego żywienia
W przyszłości dietę dziecka można zbliżyć do normalnych parametrów poprzez poszerzenie asortymentu produktów, zwiększenie dziennej objętości spożywanego pokarmu i zmniejszenie liczby karmień. Okres wzmożonego żywienia, podczas którego dziecko otrzymuje dietę wysokokaloryczną (130-145 kcal/kg/dobę) w połączeniu z lekami poprawiającymi trawienie i wchłanianie pokarmu. Objętość karmienia należy zwiększać stopniowo, pod ścisłą kontrolą stanu dziecka (tętno i częstość oddechów). Przy dobrej tolerancji na etapie żywienia wzmożonego zapewnia się żywienie wysokokaloryczne (150 kcal/kg dziennie) ze zwiększoną zawartością składników odżywczych, ale ilość białka nie przekracza 5 g/kg dziennie, tłuszczów – 6,5 g/kg dziennie, węglowodany – 14-16 g/kg dziennie. Średni czas trwania etapu zwiększonego odżywiania wynosi 1,5-2 miesiące.
W celu uzupełnienia niedoborów mikroelementów charakterystycznych dla każdej postaci PEM stosuje się formy dawkowania witamin i mikroelementów. Wymaga to niezwykle zrównoważonego podejścia. Pomimo dość dużej częstości występowania niedokrwistości w PEM, suplementów żelaza nie stosuje się we wczesnych stadiach karmienia piersią. Korektę sideropenii przeprowadza się dopiero po ustabilizowaniu stanu, przy braku oznak procesu zakaźnego, po przywróceniu podstawowych funkcji przewodu żołądkowo-jelitowego, apetytu i utrzymującym się przybieraniu na wadze, to znaczy nie wcześniej niż 2 tygodnie od dnia rozpoczęcie terapii. W przeciwnym razie terapia ta może znacznie zwiększyć nasilenie stanu i pogorszyć rokowanie w przypadku rozwoju infekcji.
W celu uzupełnienia niedoborów mikroelementów należy dostarczać żelazo w dawce 3 mg/kg dziennie, cynk 2 mg/kg dziennie, miedź – 0,3 mg/kg dziennie, kwas foliowy (pierwszego dnia – 5 mg, a następnie – 1 mg/kg dziennie).mg/dzień), a następnie przepisać preparaty multiwitaminowe, biorąc pod uwagę indywidualną tolerancję.
Tabela 8 – Niezbędne leki:
| Nazwa | Zakres terapeutyczny | Kurs leczenia |
| Mieszanka „Nutrilon Pepti Gastro”, „Alfare”, „Nutrilak Peptidi TSC”, mieszanki dla wcześniaków, mieszanki dla dzieci powyżej 1 roku życia „Nutrien Elemental”, „Nutrien Immun” (UD - A) | kalkulacja w zależności od okresu adaptacyjnego |
korekta indywidualna, 2-3 miesiące W zależności od objawów klinicznych, w przypadku CF – na całe życie (patrz protokół leczenia CF) Długoterminowe, 3-6 miesięcy Czas trwania kursu 2-3 miesiące Czas trwania 1 miesiąc Czas trwania 2 miesiące Czas trwania 2 miesiące Czas trwania 1 miesiąc |
| Pankreatyna (UD - B) | 1000 U\kg dziennie lipazy, z CF 6000-10000 IU\kg\dzień lipazy | |
| Cholekalcyferol (UD - B) | 500-3000 j./dzień, 1-4 krople 1 raz dziennie | |
| Siarczan żelazawy (UD - A) | 4 mg\kg 3 razy dziennie, doustnie | |
| Retinol | dzienne zapotrzebowanie na witaminę A dla dzieci: do 1 roku życia – 1650 jm (0,5 mg), od 1 roku do 6 lat – 3300 jm (1 mg), od 7 lat i więcej – 5000 jm (1,5 mg). | |
| Tokoferol (UD - A) | dla dzieci powyżej 10. roku życia dzienna dawka witaminy wynosi 8-10 mg, dla dzieci do 3. roku życia dawka dzienna wynosi od 3 do 6 mg, dla dzieci poniżej 10. roku życia nie więcej niż 7 mg . | |
| Kwas foliowy (UD - A) | dawka podtrzymująca dla noworodków – 0,1 mg/dzień; dla dzieci do 4. roku życia – 0,3 mg/dzień; dla dzieci powyżej 4. roku życia i dorosłych – 0,4 mg/dzień. W przypadku hipo- i niedoborów witamin (w zależności od stopnia niedoboru witamin): wiek 12 lat – do 5 mg/dobę; dzieci – w mniejszych dawkach w zależności od wieku | |
|
Siarczan cynku (UD - B) |
2-5 mg/dzień | |
| Preparaty zawierające mikroorganizmy przeciwbiegunkowe (Lactobacillus, Bifidobacterium, spory Bacillus clausii) (UD - C) | w dawce wiekowej |
Leczenie farmakologiczne świadczone na poziomie stacjonarnym:
w zależności od przyczyny, która doprowadziła do PEM. W przypadku stopnia PEN II - III zapewnia się kompleksowe wsparcie żywieniowe metodą żywienia dojelitowego i pozajelitowego.
Uzasadnionym rodzajem żywienia dojelitowego w ciężkich postaciach PEM jest długotrwałe żywienie dojelitowe, które polega na ciągłym, powolnym dostarczaniu składników odżywczych do przewodu pokarmowego (żołądek, dwunastnica, jelito czcze – kroplówka, optymalnie – za pomocą pompy infuzyjnej).
Tabela 9 – Obliczanie żywienia dla III etapu PEN w okresie adaptacyjnym
Tabela 10 - Obliczanie żywienia dla etapu III PEN w okresie naprawy
Do diety dziecka stopniowo wprowadzane są wysokokaloryczne pokarmy uzupełniające, istnieje możliwość wprowadzenia dostosowanych receptur mleka fermentowanego.
Przy dobrej tolerancji przepisanej diety na etapie żywienia wzmożonego zawartość kalorii wzrasta do 130-145 kcal/kg/dzień w przeliczeniu na prawidłową masę ciała, przy zwiększonej zawartości składników odżywczych, ale nie więcej: białka - 5 g/kg/ dziennie, tłuszcze – 6,5 g/kg/dzień, węglowodany – 14-16 g/kg/dzień. Średni czas trwania etapu wzmożonego odżywiania wynosi 1,5–2 miesiące (patrz tabela 7).
Tabela 11 – Wskaźniki adekwatności terapii dietetycznej
Tabela 12 – Niezbędne leki na poziomie szpitala
Aby skorygować zespoły wiodące, zaleca się:
| ZAJAZD | Zakres terapeutyczny | Kurs leczenia | ||
|
Korekta zaburzeń metabolizmu białek: 1) Obecność obrzęku hipoproteinemicznego, przywrócenie ciśnienia onkotycznego |
||||
| Roztwór albuminy 10% | 3-10ml/kg/dzień IV, kroplówka | aż do uzyskania efektu pod kontrolą proteinogramu i parametrów hemodynamicznych | ||
| 2) Żywienie pozajelitowe | ||||
| Roztwory aminokwasów | 2-5 lat - 15 ml/kg/dzień, 6-14 lat - 10 ml/kg/dzień IV, kroplówka | aż do uzyskania efektu pod kontrolą gospodarki wodno-elektrolitowej w surowicy krwi | ||
| Emulsje tłuszczowe |
0,5 - 2,0 g\kg/dzień, dożylnie, kroplówka |
aż do uzyskania efektu pod kontrolą stężenia trójglicerydów w osoczu | ||
| Korekta procesów metabolicznych przeprowadzane na tle przywróconego poziomu białka we krwi: | ||||
| Orotan potasu | 10-20 mg/kg/dzień doustnie | 3-4 tygodnie | ||
| Lewokarnityna |
> 12 lat 2-3 g/dzień 6-12 lat - 75 mg/kg/dzień, 2-6 lat - 100 mg/kg/dzień, do 2 lat - 150 mg/kg/dzień doustnie |
3-4 tygodnie | ||
| Korekta zaburzeń wodno-elektrolitowych: Zalecana jest terapia skojarzona (proporcje roztworów zależą od rodzaju odwodnienia) | ||||
| Roztwór chlorku sodu 0,9% | 20 -100 ml/kg/dzień (w zależności od wieku i całkowitej masy ciała) IV, kroplówka | Do czasu uzyskania efektu, pod kontrolą gospodarki wodnej i poziomu elektrolitów w surowicy krwi. | ||
| Roztwory glukozy 5%, 10% | szybkość podawania nie powinna przekraczać 0,75 g/kg/h IV, kroplówka | |||
| Roztwór chlorku potasu 4%, 7,5% rozcieńczony 10% roztworem glukozy + insulina w zależności od objętości roztworu glukozy | dawkę ustala się na podstawie niedoboru potasu we krwi, IV, kroplówki | |||
| Uzupełnianie niedoborów mikroelementów: | ||||
| Połączone preparaty wapnia | 3-4 tygodnie | |||
| Mieszane preparaty magnezu | ||||
| Korekta hipowitaminozy: możliwa jest kombinacja leków | ||||
| Pirydoksyna (B1) | 0,02-0,05 g/dzień domięśniowo | 7-10 dni | ||
| Tiamina (B6) | 12,5 mg/dzień domięśniowo | |||
| Cyjanokobalamina (B12) | 30 -100 mcg/dzień podskórnie | |||
| Kwas askorbinowy 5% | 1-2 ml dziennie domięśniowo | |||
| Retinol | dzieci powyżej 7. roku życia 5000 j.m. doustnie | w ciągu 2-3 tygodni | ||
| Krzywica:(patrz protokół leczenia krzywicy) | ||||
| Niedokrwistość z niedoboru żelaza:(patrz protokół leczenia IDA u dzieci) | ||||
| Korekta zaburzeń trawienia: | ||||
| Mikrokapsułkowe enzymy trzustkowe | 1000-2000 j./kg/dzień, doustnie | 7-21 dni | ||
| Korekta zaburzeń dysbiotycznych: | ||||
| Probiotyki zawierające bifidobakterie, pałeczki kwasu mlekowego | w zależności od dawki wiekowej | w ciągu 2-4 tygodni | ||
Do prowadzenia całkowitego żywienia pozajelitowego dawka aminokwasów powinna wynosić 2-2,5 g/kg, tłuszcze - 2-4 g/kg, glukoza - 12-15 g/kg. W tym przypadku podaż energii wyniesie 80-110 kcal/kg. Do wskazanych dawek należy podchodzić stopniowo, zwiększając ilość podawanych leków zgodnie z ich tolerancją, zachowując przy tym niezbędną proporcję substratów plastycznych i energetycznych (patrz algorytm tworzenia programów PP).
Przybliżone dzienne zapotrzebowanie energetyczne wynosi od 2 tygodni do 1 roku – 110-120 kcal/kg.
Żywienie pozajelitowe odbywa się głównie dożylnie. Przez żyły centralne wykonuje się je w przypadkach, gdy PN ma być prowadzone dłużej niż 1 tydzień i gdy żyły obwodowe są słabo zaznaczone. Zastosowanie centralnej drogi żylnej jest szczególnie wskazane u pacjentów, którzy wraz z PN wymagają innych działań intensywnej terapii. W celu wykluczenia zapalenia żył i zakrzepowego zapalenia żył podaje się stężone roztwory glukozy (> 5%) wyłącznie przez żyły centralne. Gdy PN trwa nie dłużej niż 1 tydzień, uwidocznione są żyły obwodowe i stosuje się roztwory izotoniczne, preferuje się obwodową drogę wlewu leku. Ważnym czynnikiem wchłaniania azotowokalorycznych źródeł PP jest jednoczesne stosowanie (poprzez dwa równoległe zakraplacze) mieszanin aminokwasów i emulsji tłuszczowych (lub roztworów glukozy). W przeciwnym razie aminokwasy można również wykorzystać do celów energetycznych. Emulsji tłuszczowych nie należy mieszać z roztworami elektrolitów i lekami (ze względu na ryzyko sklejania się cząstek tłuszczu). Ze względu na przypadki wystąpienia działań niepożądanych po przetoczeniu emulsji tłuszczowych (dreszcze, gorączka, bóle w klatce piersiowej, bóle krzyża, nudności, wymioty itp.), zabieg należy wykonywać w ciągu dnia, w obecności personelu medycznego. W niektórych przypadkach, jeśli występuje indywidualna nietolerancja leku, jego wlew rozpoczyna się pod osłoną domięśniowego podania leku przeciwhistaminowego (suprastyna, difenhydramina). Elektrolit, składniki pierwiastków śladowych i kwas askorbinowy można dodać do 5; 10; 20% roztwory glukozy. Witaminy z grupy B podaje się osobno, domięśniowo.
Żywienie pozajelitowe przez żyły centralne przeprowadza się po wstępnym cewnikowaniu jednej z żył dużego kalibru, najczęściej szyjnej.
Wszystkie leki należy podawać z minimalną szybkością (w ciągu 22-24 godzin), co zapewnia maksymalne wchłanianie podanych substancji i znacznie zmniejsza możliwość powikłań. Preparaty białkowe można mieszać ze stężonymi roztworami glukozy, elektrolitów, witamin i mikroelementów. Niedopuszczalne jest mieszanie tych substancji w jednym naczyniu z emulsjami tłuszczowymi.
Algorytm kompilacji programów PP:
Rozwiązanie problemu stosowania leków do terapii infuzyjnej specjalnego przeznaczenia (krew, osocze, immunoglobuliny) i ich objętości.
Obliczanie ilości stężonych roztworów elektrolitów potrzebnych dziecku na podstawie fizjologicznego, dobowego zapotrzebowania oraz wielkości stwierdzonego niedoboru. Przy obliczaniu zapotrzebowania na sód należy uwzględnić jego zawartość w substytutach krwi i roztworach stosowanych do iniekcji dożylnych.
Oznaczanie objętości roztworu aminokwasów:
Na podstawie następujących przybliżonych obliczeń (Tabela 13):
Tabela 13 – Objętość roztworu aminokwasów
Oznaczanie objętości emulsji tłuszczowej.
Na początku stosowania jego dawka wynosi 0,5 g/kg, następnie zwiększa się do 2,0 g/kg.
Oznaczanie objętości roztworu glukozy.
Dzienna dawka glukozy (z wyjątkiem noworodków) nie powinna przekraczać 6-7 g/kg, jednak aby zapewnić odpowiednią skuteczność węglowodanów, jej dawka nie powinna być mniejsza niż 2-3 g/kg dziennie. Szybkość wykorzystania glukozy w stanie prawidłowym wynosi 3 g/kg/h, a w patologii może spaść do 1,8-2 g/kg/h. Wartości te określają szybkość podawania glukozy – nie większą niż 0,5 g/kg/h. Aby zwiększyć wykorzystanie glukozy, w przypadku wzrostu poziomu cukru we krwi do 10 mmol/l wskazane jest stosowanie insuliny w dawce 1 jednostka na 4-5 gramów suchej masy glukozy.
Pierwszego dnia PN przepisuje się 10% roztwór glukozy, drugiego - 15%, od trzeciego dnia - 20% roztwór (pod kontrolą poziomu glukozy we krwi).
Sprawdzenie i ewentualnie skorygowanie zależności pomiędzy substratami plastycznymi i energetycznymi. Jeżeli podaż energii w przeliczeniu na 1 g aminokwasów jest niewystarczająca, należy zwiększyć dawkę glukozy i/lub tłuszczu lub zmniejszyć dawkę aminokwasów.
Rozdzielić powstałe objętości leków do infuzji, biorąc pod uwagę fakt, że emulsja tłuszczowa nie miesza się z innymi lekami i jest podawana albo w sposób ciągły przez cały dzień przez trójnik, albo jako część ogólnego programu infuzji w dwóch lub trzech dawkach po szybkość nie przekraczająca 5-7 ml/godzinę. Roztwory aminokwasów miesza się z roztworami glukozy i elektrolitów. Szybkość ich podawania oblicza się tak, aby całkowity czas infuzji wynosił 24 godziny na dobę.
Podczas przeprowadzania częściowego PN obliczenia przeprowadza się zgodnie z powyższym algorytmem, ale biorąc pod uwagę objętość żywności, jej wartość energetyczną i zawartość białka w mleku.
Leczenie farmakologiczne świadczone na etapie nagłym:
w zależności od przyczyny, która doprowadziła do PEM.
· Korekta hipoglikemii;
Tabela 14 – Zapobieganie/leczenie hipoglikemii w niedożywieniu białkowo-energetycznym
| Stan dziecka | Pierwszy etap leczenia | Dalsze leczenie |
| Jeśli świadomość nie jest zaburzona, ale poziom glukozy w surowicy jest niższy niż 3 mmol/l | Wskazane jest podanie w bolusie 50 ml 10% roztworu glukozy lub sacharozy (1 łyżeczka cukru na 3,5 łyżki wody) przez usta lub zgłębnik nosowo-żołądkowy | Następnie takie dzieci są karmione często - co 30 minut przez 2 godziny w objętości 25% objętości zwykłego pojedynczego karmienia, a następnie przechodzą na karmienie co 2 godziny bez przerwy nocnej |
| Jeśli dziecko jest nieprzytomne, ospałe lub ma drgawki hipoglikemiczne | Konieczne jest podanie dożylne 10% roztworu glukozy w ilości 5 ml/kg. | Następnie koryguje się glikemię podając roztwór glukozy (50 ml 10% roztworu) lub sacharozy przez zgłębnik nosowo-żołądkowy i przechodząc na częste karmienia co 30 minut przez 2 godziny, a następnie co 2 godziny bez przerwy nocnej. |
U wszystkich dzieci z nieprawidłowym stężeniem glukozy w surowicy wskazana jest terapia antybakteryjna lekami o szerokim spektrum działania.
· Korekcja hiper/hipotermii;
Tabela 15 – Zapobieganie/leczenie hipotermii w niedożywieniu białkowo-energetycznym (Koletsko B., 2009)
· Korekta odwodnienia;
Tabela 16 – Prowadzenie terapii nawadniającej w przypadku niedoborów białkowo-energetycznych (Bauer K., Jochum F., 1999)
| terapia nawadniająca | karmienie | monitorowanie stanu | ||
| pierwsze 2 godziny |
późniejszy 4-10 godzin |
po 10 godzinach terapii nawadniającej |
Pierwszy 2 godziny |
późniejszy 12 godzin |
|
w przypadku objawów odwodnienia lub wodnistej biegunki stosuje się terapię nawadniającą przez usta lub przez sondę nosowo-żołądkową roztworem do nawadniania dzieci z PEM (ReSoMal) w ilości 5 ml/kg co 30 minut przez 2 godziny; podawać ten sam roztwór w ilości 5-10 ml/kg na godzinę, zastępując podawanie roztworu nawadniającego karmieniem mlekiem modyfikowanym lub mlekiem matki po 4, 6, 8 i 10 godzinach |
co 2 godziny bez przerwy na noc |
każdy 30 minut |
każdą godzinę | |
|
- Puls, - częstość oddechów, - częstotliwość i objętość oddawania moczu, - częstotliwość stolca, - częstotliwość wymiotów |
||||
· Korekta równowagi elektrolitowej:
Należy zadbać o regularne dostarczanie dziecku niezbędnych minerałów w wystarczającej ilości. Zaleca się stosowanie potasu w dawce 3-4 mmol/kg dziennie, magnezu w dawce 0,4-0,6 mmol/kg dziennie. Pożywienie dla dzieci z PEM należy przygotowywać bez soli, do nawodnienia stosuje się wyłącznie roztwór ReSoMal. Do skorygowania zaburzeń elektrolitowych należy zastosować specjalny roztwór elektrolitowo-mineralny zawierający (w 2,5 l) 224 g chlorku potasu, 81 g cytrynianu potasu, 76 g chlorku magnezu, 8,2 g octanu cynku, 1,4 g siarczanu miedzi, 0,028 g selenian sodu, 0,012 g jodku potasu, w ilości 20 ml tego roztworu na 1 litr pożywienia.
Inne rodzaje leczenia: w zależności od patologii, która doprowadziła do PEM.
Chirurgia: w przypadku patologii wymagającej korekcji chirurgicznej (wrodzona wada rozwojowa przewodu żołądkowo-jelitowego, wrodzona choroba serca).
Wskaźniki skuteczności leczenia:
· odpowiedni wzrost wskaźników masy i wzrostu;
· eliminacja przyczyny PEM;
· korzystne rokowanie w sprawie choroby podstawowej, która doprowadziła do PEM.
Leki (składniki aktywne) stosowane w leczeniu
| Albumina ludzka |
| Kwas askorbinowy |
| Bifidobacterium bifidum |
| Glukoza |
| Siarczan żelaza |
| Emulsje tłuszczowe do żywienia pozajelitowego |
| Chlorek potasu (chlorek potasu) |
| Kolekalcyferol |
| Kompleks aminokwasów do żywienia pozajelitowego |
| Lactobacilli |
| Lewokarnityna |
| Chlorek sodu |
| Kwas orotowy |
| Pankreatyna |
| Pirydoksyna |
| Retinol |
| Mieszanki żywienia dojelitowego |
| Zarodniki Bacillus clausii, wielooporne na różne leki chemioterapeutyczne i antybiotyki |
| Tiamina |
| Tokoferol |
| Kwas foliowy |
| Cyjanokobalamina |
| Siarczan cynku |
Grupy leków według ATC stosowanych w leczeniu
Hospitalizacja
Wskazania do hospitalizacji ze wskazaniem rodzaju hospitalizacji: (planowa, pilna):
Wskazania do hospitalizacji w trybie nagłym i planowym:
· stany zagrożenia życia ze względu na stopień PEM II-III;
Wskazania do planowej hospitalizacji:
· wyjaśnienie etiologii stopnia PEM II-III (pierwotnego lub wtórnego);
· leczenie niemożliwych w warunkach ambulatoryjnych stopni PEM II-III stopnia (korekta zaburzeń wodno-elektrolitowych, leczenie infekcji, żywienie pozajelitowe, niewydolność wielonarządowa);
· hospitalizacja w specjalistycznym szpitalu zaburzeń poznawczych.
Zapobieganie
Działania zapobiegawcze:
· optymalna pielęgnacja;
· regularne badania lekarskie;
· odżywianie o wystarczającej częstotliwości i objętości, o odpowiedniej kaloryczności i zawartości niezbędnych składników odżywczych;
· korekta witaminowo-mineralna;
Dalsze postępowanie (po hospitalizacji):
· rozszerzenie diety;
· zapewnienie przyrostu masy ciała i wzrostu;
· stymulacja sensoryczna i wsparcie emocjonalne;
· dalsza rehabilitacja;
Informacja
Źródła i literatura
- Protokoły z posiedzeń Rady Ekspertów RCHR przy Ministerstwie Zdrowia Republiki Kazachstanu, 2015
- Wykaz wykorzystanej literatury: 1. Żywienie pozajelitowe i dojelitowe: podręcznik krajowy / pod red. M.Sh. Chubutia, T.S. Popova.-M.: GEOTAR-Media, 2014.- 162-198 s. 2. Przewodnik po żywieniu klinicznym. wyd. Lufta V.M., Bagnenko S.F., Shcherbuka Yu.A. St. Petersburg, 2010. 428 s. 3. Krajowy program optymalizacji żywienia dzieci w pierwszym roku życia w Federacji Rosyjskiej. wyd. Baranova A. A., Tutelyan V. A. M., 2010. 68 s. 4. Dietetyka kliniczna dzieciństwa. Poradnik dla lekarzy. wyd. T. E. Borovik, K. S. Ladodo. M.: Medycyna, 2008. 606 s. 5. Uglitskikh A.K. Kompleksowa ocena stanu odżywienia dzieci przebywających w szpitalu // Znieczulenie. i resuscytator. 2005. Nr 2, s. 2005. 52–57. 6. Calder P. C. Kwasy tłuszczowe ω-3, zapalenie i znaczenie odporności dla pacjentów pooperacyjnych i krytycznie chorych // Lipidy. 2004; 39:1147–1161. 7. Mazurin A.V., Woroncow I.M. Propedeutyka chorób wieku dziecięcego. Petersburg, „Foliant”, 2000. - s. 827-923. 8. Krajowy program optymalizacji żywienia dzieci w pierwszym roku życia w Federacji Rosyjskiej, Moskwa, 2008. 9. Żywienie dziecka zdrowego i chorego. /Podręcznik dla lekarzy. Pod redakcją Tutelyana V.A., Konyi I.Ya., Kaganova B.S. M., 2007.- s. 51-52, 60-62. 10. Gastroenterologia dziecięca: przewodnik dla lekarzy / pod red. N.P. Shabalov. wyd. 2, poprawione - M.: MEDpress-inform, 2013.-187-427 11. Kleiman: Nelson Textbook of Pediatrics, wyd. 18, 2007, rozdział 43. 12. Sermet-Gauelus I., Poisson-Salomon A. S. , Colomb V. i in. Prosta ocena ryzyka żywieniowego u dzieci w celu identyfikacji dzieci zagrożonych niedożywieniem // AJCN. 2000. V. 72. R. 64–70. 13. Sawaya A. L., Martins P. A., Martins V. J. B. i in. Niedożywienie, długotrwałe zdrowie i skutki odżywienia // Nestle Nutrition Institute. 2009, 63, s. 2009. 95–108. 14. Praktyczne umiejętności pediatry./Podręcznik dla lekarzy. Pod redakcją Usova I.N. i in. Mn.: Szkoła wyższa, 1990.- s. 28-39 15. Pediatria: podręcznik krajowy / pod red. A.A. Baranowa. – M., 2009.-165-167p. 16. Collins S, Dent N, Binns P i in., Zarządzanie poważnym ostrym niedożywieniem u dzieci. www.thelancet.com 2010 17. Przewlekłe zaburzenia odżywiania u małych dzieci / pod red. R. A. Avdeev, N. L. – Krasnojarsk: KrasSMA Publishing House, 2008. 18. B. Koletzko, C. Agostoni, P. Ball, V. Carnielli, C. Chaloner, J. Clayton, V. Colomb, M. Dijsselhof, C. Fusch, P. Gandullia i in. Wytyczne ESPEN/ESPGHAN dotyczące żywienia pozajelitowego dzieci. J Pediatr Gastroenterol Nutr, tom. 41, Dodatek 2 listopada 2005 19. Biesalski HK, Bischoff SC, Boehles HJ, Muehlhoefer A, Grupa robocza ds. opracowania wytycznych dotyczących żywienia pozajelitowego Niemieckiego Stowarzyszenia Medycyny Żywieniowej. Woda, elektrolity, witaminy i pierwiastki śladowe – Wytyczne dotyczące żywienia pozajelitowego, rozdział 7. GMS Ger Med Sci. 2009;7: Dok21. 4. 20. Fusch C, Bauer K, Böhles HJ, Jochum F, Koletzko B, Krawinkel M, Krohn K, Mühlebach S, Grupa robocza ds. opracowania wytycznych dotyczących żywienia pozajelitowego Niemieckiego Towarzystwa Medycyny Żywieniowej. Neonatologia/Pediatria – Wytyczne dotyczące żywienia pozajelitowego, rozdział 13. GMS Ger Med Sci. 2009;7: 21. Podstawy żywienia klinicznego: Materiały wykładowe do kursów Europejskiego Stowarzyszenia Żywienia Pozajelitowego i Dojelitowego: Trans. z angielskiego / rozdz. wyd. L. Sobotka. - wyd. 2 - Pietrozawodsk: IntelTek, 2003. - 416 s. 22. Popova T.S., Shestopalov A.E. i in. Wsparcie żywieniowe pacjentów w stanie krytycznym. -M.: LLC „Publishing House” M-Vesti”, 2002. - 320 s. 23. Żywienie pozajelitowe noworodków: podręcznik kliniczny pod redakcją Volodina N.N. - Moskwa, 2015 s. 27 24.WHO Postępowanie w przypadku ciężkiego niedożywienia: podręcznik dla lekarzy i innych starszych pracowników służby zdrowia Genewa: WHO 2003 25. Ann Ashworth, Sultana Khanum i wsp. Wytyczne dotyczące leczenia szpitalnego poważnie niedożywionych dzieci Genewa: WHO 2003
Informacja
Twórcy:
1) Nazarova A.Z. - Kandydat nauk medycznych, Kierownik Katedry Kliniczno-Diagnostycznej Centrum Naukowego Pediatrii i Chirurgii Dziecięcej.
2) Sharipova M.N. - Doktor nauk medycznych, Zastępca Dyrektora ds. Pracy Naukowej Centrum Naukowego Pediatrii i Chirurgii Dziecięcej.
3) Adamova G.S. - Kandydat nauk medycznych, lekarz oddziału somatyki złożonej Centrum Naukowego Pediatrii i Chirurgii Dziecięcej.
4) Litvinova L.R. - farmakolog kliniczny Krajowego Naukowego Centrum Kardiochirurgii SA.
Nie ma konfliktu interesów.
Recenzent:
1) Khabizhanov B.Kh. - Doktor nauk medycznych, profesor Katedry Staży i Rezydencji w Pediatrii nr 2 KazNMU imienia S. Asfendiyarov;
2) Dzhaksylykova K.K. - Doktor nauk medycznych, profesor Katedry Staży w Pediatrii i Chirurgii Dziecięcej Państwowego Uniwersytetu Medycznego w Semey.
Warunki rozpatrzenia protokołu: przeglądu protokołu 3 lata po jego opublikowaniu i od daty jego wejścia w życie lub jeżeli dostępne będą nowe metody o odpowiednim poziomie dowodów.
Załączone pliki
Uwaga!
- Samoleczenie może spowodować nieodwracalne szkody dla zdrowia.
- Informacje zamieszczone na stronie internetowej MedElement oraz w aplikacjach mobilnych „MedElement”, „Lekar Pro”, „Dariger Pro”, „Choroby: Poradnik terapeuty” nie mogą i nie powinny zastępować bezpośredniej konsultacji z lekarzem. Jeśli masz jakiekolwiek niepokojące Cię choroby lub objawy, skontaktuj się z placówką medyczną.
- Wybór leków i ich dawkowanie należy omówić ze specjalistą. Tylko lekarz może przepisać odpowiedni lek i jego dawkowanie, biorąc pod uwagę chorobę i stan organizmu pacjenta.
- Strona internetowa MedElement oraz aplikacje mobilne „MedElement”, „Lekar Pro”, „Dariger Pro”, „Choroby: Katalog Terapeuty” stanowią wyłącznie źródło informacji i referencji. Informacje zamieszczone na tej stronie nie powinny być wykorzystywane do bezprawnej zmiany zaleceń lekarskich.
- Redaktorzy MedElement nie ponoszą odpowiedzialności za jakiekolwiek obrażenia ciała lub szkody majątkowe powstałe w wyniku korzystania z tej witryny.
6237 0
Niedostateczna podaż składników odżywczych i energii z pożywienia (częściowy lub całkowity głód) prowadzi do rozwoju stanu patologicznego organizmu, na co wskazuje m.in. Międzynarodowa Klasyfikacja Chorób i Przyczyn Śmierci, wersja 10 (ICD-10) Jak niedożywienie białkowo-energetyczne (PEM).
W literaturze medycznej istnieją inne terminy odnoszące się do tej choroby: dystrofia żywieniowa, niedożywienie, niedobór substratu energetycznego, kacheksja.
Termin PEM nie oddaje dokładnie istoty problemu, gdyż wraz z niedoborem białka i energii z reguły dochodzi do niedoboru innych składników odżywczych (witaminy, minerały, tłuszcze, węglowodany).
Przyczyny niedożywienia białkowo-energetycznego
Zarówno w przeszłości, jak i obecnie, niedożywienie ma w większości przypadków przyczyny społeczne. Należą do nich ekstremalne warunki (uderzającym przykładem jest blokada Leningradu), formy protestu dotyczące głodu i biedy. Do rozwoju PEM przyczynia się również wiele chorób.Główne powodyniedożywienie białkowo-energetyczne:
1. Niewystarczająca podaż składników odżywczych:
A) przyczyny społeczno-ekonomiczne, religijne i inne;
b) przyczyny jatrogenne (hospitalizacja, posty spowodowane badaniami, diety szpitalne, ograniczenia dietetyczne w przypadku różnych chorób, nieracjonalne sztuczne odżywianie);
C) zaburzenia psychoneuroendokrynne z tłumieniem apetytu i wypaczeniem zachowań żywieniowych (anoreksja neurogenna, psychoza);
d) mechaniczne zaburzenia przyjmowania pokarmu doustnie: niedrożność przewodu pokarmowego, zaburzenia uzębienia, dysfagia;
2. Zaburzenia trawienia i/lub wchłaniania składników odżywczych: zespoły złego trawienia i złego wchłaniania.
3. Stany hiperkataboliczne:
A) stany, w których uwalniane są cytokiny przyspieszające katabolizm, nowotwory, gorączka, infekcje;
b) choroby endokrynologiczne z upośledzonym anabolizmem i przyspieszonym katabolizmem (nadczynność tarczycy, cukrzyca).
5. Zwiększona utrata składników odżywczych (zaburzenia związane z utratą białka i innych składników odżywczych) zespół nerczycowy, przewlekła obturacyjna choroba płuc, przetoki jelitowe, enteropatia wysiękowa, plazmorok w chorobie oparzeniowej, złuszczające zapalenie skóry.
6. Zwiększone zapotrzebowanie na składniki odżywcze:
A) warunki fizjologiczne (ciąża, laktacja, dzieciństwo i okres dojrzewania);
b) stany patologiczne (okres rekonwalescencji po urazach i ostrych chorobach zakaźnych, okres pooperacyjny).
7. Przyjmowanie do organizmu antagonistów składników odżywczych: alkoholizm, zatrucie antagonistami witamin i lekami.
Występowanie niedożywienia białkowo-energetycznego
Według szacunków FAO/WHO pod koniec XX wieku na planecie głodowało co najmniej 400 milionów dzieci i 0,5 miliarda dorosłych. Ich liczba wzrosła o jedną czwartą w ciągu 15 lat, a odsetek niedożywionych dzieci na świecie wzrósł pod koniec lat 90-tych.Spożycie ryb w Rosji w latach 1987–1998 spadło o 2/3; mięso, drób i cukier - o 1/2; kiełbasy, margaryna i masło - o 1/3. Wybiórcze badania żywienia ludności rosyjskiej wykazały, że około 25% ankietowanych jest niedożywionych, a 80% ma niedobory witamin i mikroelementów.
PEM jest jednym z głównych problemów pacjentów szpitali medycznych i chirurgicznych. Liczne badania wykazały, że ponad 50% pacjentów rozpoczynających leczenie cierpi na niedobory białkowo-energetyczne i ciężką hipowitaminozę (szczególnie niedobór kwasu foliowego, witamin B2 i C).
W 1994 roku McWriter i Pennington ocenili stan odżywienia 500 pacjentów na różnych oddziałach szpitali w Wielkiej Brytanii i zidentyfikowali PEM u 200 pacjentów (40%).

Ryż. 35.1. Stan odżywienia pacjentów 5 rodzajów oddziałów, określony w 100 szpitalach w Wielkiej Brytanii (McWriter, Pennington, 1994): 1 – oddziały chirurgiczne; 2 - oddziały terapeutyczne; 3 - oddziały pulmonologiczne; 4 - oddziały urazowe; 5 - oddziały geriatryczne.
Według klinik Ogólnorosyjskiego Centrum Badań Naukowych Akademii Nauk Medycznych ZSRR, post szpitalny wśród pacjentów chorych na raka występuje w 30% przypadków. Wśród osób leczonych ambulatoryjnie z powodu chorób przewlekłych i nowotworów około 10% ma także oznaki niedożywienia.
Koszt hospitalizacji pacjenta w prawidłowym stanie odżywienia jest około 1,5–5 razy niższy niż pacjenta niedożywionego.
U pacjentów z niedożywieniem białkowo-energetycznym znacznie częściej występuje opóźnione gojenie się ran, uszkodzenie szwów, zwiększona śmiertelność, dłuższy czas hospitalizacji i rekonwalescencji oraz powikłania infekcyjne.
Patogeneza niedożywienia białkowo-energetycznego
Zmniejszone spożycie składników odżywczych, niezależnie od etiologii, powoduje podobne zmiany. Jest to utrata nie tylko tkanki tłuszczowej i mięśniowej, ale także tkanki kostnej i trzewnej.Post wymaga od organizmu ogólnego oszczędzania energii i tworzyw sztucznych. Jednak podobnie jak w przypadku cukrzycy insulinozależnej, całkowity post stwarza metaboliczną sytuację redystrybucji zasobów na korzyść narządów i tkanek niezależnych od insuliny. Struktury insulinozależne znajdują się w najbardziej niekorzystnej sytuacji. Zapasy glikogenu wystarczą na około jeden dzień.
Przy niewielkim poszczeniu wątroba dostarcza do 75% glukozy poprzez rozkład glikogenu. Wydłużenie czasu trwania postu prowadzi do wzrostu poziomu glukoneogenezy, lipolizy i ketogenezy. Produkcja insuliny maleje, a obraz hormonalno-metaboliczny postu jest silnie zdominowany przez działanie kompleksu regulatorów przeciwstawnych.
W tym przypadku mobilizowane są zasoby energetyczne somatycznego składnika organizmu – mięśni szkieletowych i tkanki tłuszczowej. Białko mięśniowe ma wartość energetyczną około 40 000 kcal. Występuje ujemny bilans azotowy na poziomie 10-12 g/dzień, co wskazuje na katabolizm 75-100 g/dzień białka. We krwi wzrasta poziom aminokwasów krótkołańcuchowych (walina, leucyna, izoleucyna). W tym przypadku utrata ponad 30% białka jest nie do pogodzenia z życiem.
Kolejnym potencjalnym źródłem energii jest tłuszcz (130 000 kcal). Aminokwasy i produkty lipolizy są wykorzystywane przez wątrobę do resyntezy glukozy i tworzenia ciał ketonowych w celu oszczędzania białka w narządach trzewnych i zaspokojenia potrzeb energetycznych mózgu.
Dzienne zapotrzebowanie energetyczne człowieka w stanie spoczynku po 3-5 dniach postu wymaga zużycia 160 g trójglicerydów, 180 g węglowodanów (syntetyzowanych w procesie glukoneogenezy) i 75 g białka mięśniowego. Zatem tłuszcze dostarczają większości energii podczas postu. Osoba z normalnymi wskaźnikami odżywienia i całkowitym postem ma wystarczające zapasy na 9-10 tygodni.
Podczas postu dochodzi do nierównomiernego ubytku masy w poszczególnych narządach, co odnotowali klasycy nauki o żywieniu. Pochodne mezodermy, a także narządy i tkanki przechowujące węglowodany i lipidy, znacznie tracą na wadze. Przy średnim deficycie masy ciała w chwili śmierci wynoszącym 50-55%, największe straty obserwuje się w tkance tłuszczowej, zmniejszonej o prawie 99% u osób zmarłych z głodu. Następuje nawet zanik tłuszczu w tłuszczakach i odwrotny rozwój złogów lipidowych w dużych tętnicach.
Sieć i krezka stają się cienkimi błonami tkanki łącznej. Nasierdzie i żółty szpik kostny są pozbawione tłuszczu, co nadaje im galaretowaty lub śluzowaty wygląd. Mięśnie szkieletowe, które również są insulinozależne, zmniejszają swoją masę o 70%. Zmiany zanikowe w narządach limfatycznych są bardzo duże: masa śledziony zmniejsza się o 72%.
Odkładanie się lipochromu obserwuje się we wszystkich zanikowych narządach, a hemosyderozę obserwuje się w śledzionie. Wątroba traci 50-60% swojej masy, gruczoły ślinowe - 65%, inne narządy trawienne - od 30 do 70%. Najbardziej wyraźny zanik błony śluzowej żołądka i aparatu gruczołowego trzustki. W kościach obserwuje się osteopatię dystroficzną z osteoporozą i złamaniami podokostnowymi.
Utrata masy ciała między krwią a skórą odpowiada w przybliżeniu względnej całkowitej utracie masy ciała, z atrofią gruczołów skórnych, ścieńczeniem naskórka i utratą brodawek skórnych.
Jednocześnie w znacznie mniejszym stopniu wyraża się zanik ważnych narządów niezależnych od insuliny. Mózg, nadnercza (zwłaszcza rdzeń) i oczy w ogóle nie tracą masy. W tym przypadku rdzeń kręgowy traci więcej masy niż mózg i wykazuje więcej oznak zmian zwyrodnieniowych.
Masowa utrata nerek wynosi 6-25%, czyli 2-9 razy mniej niż średnia. Według V.D. Zinzerlinga (1943) procesy zanikowe w ogóle nie rozprzestrzeniają się na nerki osób zmarłych z głodu. Płuca tracą 18-20% swojej masy.
Wśród gruczołów dokrewnych szczególnie silnie zanika tarczyca. W niektórych eksperymentach gonady prawie nie tracą na wadze, a zdolność seksualna głodujących zwierząt, zwłaszcza samców, utrzymuje się przez długi czas.
Na szczęście istnieją dowody na to, że post nie ma nieodwracalnego efektu sterylizującego. I tak izraelski lekarz M. Dvoretsky (1957) odnotował niezwykle wysoką dzietność w rodzinach utworzonych przez osoby, które podczas pobytu w nazistowskich obozach koncentracyjnych doznały dystrofii żywieniowej.
W czasie postu płód znajduje się w uprzywilejowanej pozycji w stosunku do ciała matki. Choć niedożywienie u kobiet w ciąży prowadzi do narodzin dzieci z niedożywieniem wewnątrzmacicznym, to jednak utrata masy ciała matki jest znacznie większa niż masy płodu. Niedostateczne żywienie kobiet karmiących piersią prowadzi do ograniczenia i zaprzestania laktacji oraz zmniejszenia zawartości białka i tłuszczu w mleku matki.
Formy niedożywienia białkowo-energetycznego
Przy wyraźnym niedoborze składników odżywczych najczęściej następuje długa faza kompensacji, podczas której mechanizmy endokrynno-metaboliczne chronią trzewną pulę białek i mobilizują tłuszcze i białka z puli somatycznej (tkanka tłuszczowa i mięśnie szkieletowe) na potrzeby energetyczne. Przejawia się to w postaci obrzękowej lub marantycznej postaci głodu (marazmu pokarmowego).W marazmie żywieniowym (zmumifikowana lub sucha postać dystrofii żywieniowej) zanik mięśni i tkanki tłuszczowej („skóry i kości”) osiąga znaczny stopień, ale skóra i włosy zwykle pozostają normalne, nie ma zmian w funkcjonowaniu wątroby i innych narządów wewnętrznych, pojawia się obrzęk. W marazmie występuje znaczny nadmiar poziomu glukokortykoidów.
Jeżeli niedobór białka rozwija się w przyspieszonym tempie na tle zapewnienia wartości energetycznej niedożywienia za pomocą węglowodanów, wówczas kompensacja może już od początku być niewystarczająca w postaci oszczędzania białka trzewnego. Następnie rozwija się obrzękowa forma postu (kwashiorkor). Dekompensacja następuje wcześniej, a wskaźniki przeżycia pacjentów są mniejsze.
Słowo kwashiorkor pochodzi z języka mieszkańców Afryki Zachodniej zamieszkujących tereny dzisiejszej Ghany. Oznacza „chorobę pierworodnego po urodzeniu najmłodszego”. Kwashiorkor został po raz pierwszy opisany przez Williamsa w 1935 roku u dzieci z Afryki Zachodniej karmionych wyłącznie kukurydzą. Po odsadzeniu pierworodny zostaje pozbawiony źródła pełnowartościowego białka, a jego odżywienie staje się niewystarczające.
Kwashiorkor, będący wyrazem niedoboru białek trzewnych, charakteryzuje się obrzękami, łuszczeniem się skóry, wypadaniem włosów, często powiększeniem lub pogorszeniem czynności wątroby oraz anoreksją. W tym przypadku występuje wtórny hiperaldosteronizm i ogólnoustrojowe działanie cytokin jest wyraźne.
Niektóre przypadki wygłodzenia (niedożywienia) mogą wystąpić w sposób pośredni: początkowo bardziej przypominający formę maranty, a przy dekompensacji - formę kwashiorkoru.
Nie ma jasnej opinii, dlaczego dana osoba jest wyczerpana według tego czy innego typu. Według tradycyjnego punktu widzenia marazm rozwija się w warunkach przeważającego niedoboru energii, a kwashiorkor rozwija się w warunkach niedoboru białka.
Charakterystyczne cechy formularzy BEN przedstawiono w tabeli. 35.1. Obie formy mają wspólne objawy, na przykład niedokrwistość wieloniedoborową i hipowitaminozę.
Tabela 35.1. Formy niedożywienia białkowo-energetycznego
| Cechy charakterystyczne | Formularze BEN | |
| Kwashiorkor | Marazm | |
| Niedobór | Głównie białko | Energia i białko |
| Wygląd | Księżycowa twarz, wzdęty brzuch |
Zanik mięśni twarzy, zapadnięte policzki i dół skroniowy. Kończyny w kształcie łodygi, zanik tłuszczu podskórnego i mięśni szkieletowych. Zachamowany wzrost. Wciąga się brzuch |
|
Skóra i jej pochodne |
Plamy nieprawidłowej pigmentacji i nadmiernego rogowacenia, „dermatoza szkliwa lub łuszcząca się”, rumień. Smugi przebarwień na włosach (objaw flagi) i paznokciach. Włosy stają się jaśniejsze, nabierają czerwonawego odcienia, stają się łamliwe i łatwo wypadają |
Sucha, pomarszczona, z objawami poliwitaminozy, obniżonym turgorem. Włosy są suche, matowe, cienkie |
| Zachowanie żywieniowe | Apatia, brak apetytu | Aktywny. Apetyt obecny |
| Wątroba | Powiększone, bolesne, stłuszczenie lub stłuszczeniowe zapalenie wątroby, czasami możliwa marskość wątroby | Umiarkowana atrofia |
|
Przewód pokarmowy |
Zmiany zanikowe są mniej wyraźne |
|
|
Metabolizm wody i soli |
Obrzęki, wodobrzusze, zatrzymanie sodu, hipokaliemia, hipofosfatemia, hipomagnezemia |
Brak obrzęku. W końcowej fazie hiperkaliemii |
| Białka krwi |
Ciężka hipoalbuminemia, zmniejszone stężenie transferyny, transtyretyny i białka wiążącego retinol. Zwiększone stężenie globulin ostrej fazy. Zmniejszone VLDL i LDL |
W dolnej granicy normy VLDL może wzrosnąć |
| Układ odpornościowy |
Ciężki niedobór odporności limfocytów T i B |
Funkcje komórek T są przeważnie upośledzone |
| Tło hormonalne |
Hiperaldosteronizm, wysoki poziom kachektycznych cytokin, stosunkowo mniej glukokortykoidów. Insulina jest obniżona. Gyrotropina jest w normie. Kortyzol w normie. Somatomedyna jest zmniejszona |
Niezwykle wysoki poziom glukokortykoidów, glukagonu i somatostatyny. Insulina jest w normie. Zmniejsza się tyreotropina. Zmniejsza się poziom trójjodotyroniny. Tyroksyna w normie lub podwyższona |
|
Wydalanie kreatyniny |
Umiarkowanie zwiększone | Gwałtownie wzrosło |
| Prognoza | Pesymistyczny. Wysokie ryzyko powikłań infekcyjnych. Leczenie (żywienie) jest trudne | Lepsze od kwashiorkoru |
Według Międzynarodowej Klasyfikacji formy niedoboru białkowo-energetycznego wyróżnia się tylko w ciężkich przypadkach. Przy umiarkowanym stopniu PEM z wyraźną przewagą utraty trzewnej lub somatycznej puli białek wskazane jest postawienie diagnozy: „Umiarkowany niedobór białkowo-energetyczny z tendencją do rozwoju kwashiorkoru (marazmu)”.
Powikłania niedożywienia białkowo-energetycznego
Głównymi powikłaniami PEM, które determinują wysoką śmiertelność i koszty leczenia, są procesy infekcyjne.Częsty rozwój infekcji u pacjentów z niedoborami białkowo-energetycznymi jest związany z wieloma czynnikami, wśród których najważniejszymi są zaburzenia odpowiedzi adaptacyjnej i wtórne niedobory odporności.
Zaburzenia immunologiczne w PEM charakteryzują się przede wszystkim zaburzeniem składnika limfocytów T. Bezwzględna liczba limfocytów T maleje, ich funkcja i różnicowanie są upośledzone.
Funkcja immunoglobulin ulega zmianie. Zawartość IgG często wzrasta, ale może również spadać. Następuje spadek IgA i odpowiednio osłabienie indukcji odpowiedzi immunologicznej błon śluzowych na obecność antygenu. Dzieje się tak na skutek zmniejszenia liczby komórek wytwarzających IgA, zakłócenia syntezy wydzielanych składników oraz funkcji limfocytów T.
Wiele składników odgrywa rolę w powstawaniu niedoborów odporności w PEM (Tabela 35.2).
Tabela 35.2. Związek zaburzeń odżywiania, funkcji układu odpornościowego i podatności na infekcje (wg S. Dreizen., 1979 i R. K. Chandra, 1988)
| Zaburzenia odporności i odporności | Niedobory składników odżywczych |
| Odporność komórkowa |
Białko, energia, witaminy B6, B12, kwas foliowy |
| Odporność humoralna |
Białko, witaminy A, C, PP, B 2, B 6, kwas foliowy, pantoten, biotyna |
| Układ fagocytarno-makrofagowy, interferon, dopełniacz | Białko, energia, żelazo, kwas foliowy |
| Bariery ochronne tkanek i błon śluzowych |
Białko, witaminy A, B2, B6, B12, C, kwas foliowy, żelazo |
| Regeneracja nabłonka | Białko, witamina C, cynk |
| Synteza i dojrzewanie kolagenu |
witaminy A, PP, C, B 2, żelazo |
| Hematopoeza normoblastyczna |
Białko, żelazo, cynk, miedź, witaminy B 12, kwas foliowy |
| Krzepnięcie krwi | Białko, wapń, witamina K |
Izolowany niedobór niektórych rodzajów składników odżywczych może również prowadzić do zaburzeń układu odpornościowego. Niedobór cynku powoduje zatem zanik limfy, który można wykryć poprzez zmniejszenie reakcji nadwrażliwości typu opóźnionego (test skórny z antygenem). U osób z niedoborem żelaza lub magnezu może wystąpić zwiększona częstość występowania chorób zakaźnych i nieprawidłowych wyników testów immunologicznych.
Brak pirydoksyny, kwasu foliowego, witamin A i E prowadzi do uszkodzenia komórkowego układu odpornościowego i zakłócenia syntezy przeciwciał. Przy niedoborze witaminy C zmniejsza się aktywność fagocytarna leukocytów i zmniejsza się funkcja limfocytów T.
Zmniejszona adaptacja w przypadku niedoboru białka i energii
Zaburzenia układów adaptacyjnych są czynnikiem ograniczającym leczenie pacjentów, ponieważ wiążą się ze zmianami w możliwościach różnych układów fizjologicznych, a po przywróceniu odżywiania mogą prowadzić do stanów nierównowagi i zmienionych potrzeb żywieniowych.Ważnym punktem ograniczenia adaptacji może być zmniejszenie aktywności pompy sodowej, która odpowiada za 30% wydatków energetycznych organizmu w całkowitym spoczynku. Spadek jego aktywności prowadzi do zmian w wydatku energetycznym tkanek i zaburzenia wewnątrzkomórkowych stosunków elektrolitowych. W tym przypadku zmniejsza się labilność układu przewodzącego serca, zdolność nerek do zagęszczania moczu i zmniejsza się perystaltyka. przewód żołądkowo-jelitowy (GIT).
Inną przyczyną podstawowego wydatku energetycznego jest katabolizm białek. W PEM zawartość wewnątrzkomórkowa kwas rybonukleinowy (RNA), peptydy, enzymy. Straty aminokwasów i jonów są powiązane z kinetyką białek, które wykorzystywane są jako źródło energii.
Kolejna zaburzona funkcja adaptacyjna jest związana z odpowiedzią zapalną i odpowiedzią immunologiczną. Zmiany skórne nie są bolesne, nie puchną i nie zaczerwienią się. W przypadku zapalenia płuc badanie RTG nie ujawnia masywnego nacieku. Zakażenia dróg moczowych występują bez ropomoczu. Objawy gorączki, tachykardii i leukocytozy można złagodzić. Po wyczerpaniu funkcja termoregulacyjna jest upośledzona.
Problemy kliniczne wynikające z PEM: zanik mięśni, pogorszenie funkcji oddechowych i termoregulacyjnych, złamania, odleżyny, zmniejszone tempo gojenia się ran, zaburzenia funkcji odpornościowych i hormonalnych, zwiększona częstość powikłań pooperacyjnych, zmniejszona odporność na infekcje, depresja i wiele innych.
Wcześniej podano główne wskaźniki stosowane w praktyce klinicznej do oceny stopnia i formy niedożywienia białkowo-energetycznego. Dominujący spadek parametrów antropometrycznych charakteryzuje wyczerpanie typu marazmowego, wyraźny spadek wskaźników laboratoryjnych puli białek trzewnych (albumina, transferyna) charakteryzuje kwashiorkor. W obu postaciach choroby parametry immunologiczne ulegają pogorszeniu.
Szczególną uwagę należy zwrócić na markery białek trzewnych, gdyż ich poziom (głównie albuminy) koreluje ze śmiertelnością i rozwojem powikłań.
Podczas pracy z pacjentami osłabionymi należy zachować ostrożność podczas traktowania wszystkich danych laboratoryjnych i instrumentalnych. Praktycznie nie ma obszaru aktywności organizmu, na który PEN nie miałby wpływu.
Często niedoświadczonym klinicystom trudno jest zinterpretować wyniki badań i ich dynamikę u takich pacjentów. Trzeba pamiętać, że mogą się one znacznie różnić w zależności od stopnia nawodnienia i mogą być bardzo wysokie przed rozpoczęciem kuracji (naparów). Aby ocenić dynamikę, równolegle z wszelkimi analizami należy ocenić hematokryt.
Żywienie terapeutyczne w przypadku niedoborów białkowo-energetycznych
Leczenie PEM należy przeprowadzać w określonej kolejności. Pierwszym zadaniem jest wyrównanie określonych niedoborów żywieniowych i leczenie powikłań takich jak infekcja, zaburzenia mikroflory jelitowej i przywrócenie funkcji adaptacyjnych. W przyszłości należy opracować dietę, która przywróci utraconą tkankę. Ostatecznym celem jest normalizacja składu ciała.Wybór preferowanej metody leczeniaNiedożywienie białkowo-energetyczne zależy od dwóch głównych czynników:
1) stopień i forma BEN;
2) etiologia PEM.
Wielu ekspertów uważa, że podawanie składników odżywczych drogą wlewu dożylnego jest niebezpieczne, ponieważ może łatwo przekroczyć próg, gdy zaburzona jest zdolność do homeostazy. Całkowite lub dominujące żywienie pozajelitowe wskazane jest głównie w przypadkach, gdy pierwotną przyczyną niedoborów białkowo-energetycznych były choroby związane z zespołem złego wchłaniania lub hiperkatabolizmem. Jest również stosowany w rozwoju powikłań PEM.
Podczas stosowania żywienia pozajelitowego w początkowej fazie leczenia PEN ważne jest, aby nie podawać nadmiaru białka, kalorii, płynów i elektrolitów. Podawanie składników odżywczych przez przewód pokarmowy pozwala na wykorzystanie jelit jako bariery pomiędzy lekarzem a metabolizmem pacjenta, dlatego leczenie niedożywienia białkowo-energetycznego wymaga maksymalnego wykorzystania układu trawiennego, gdy tylko jest to możliwe.
W genezie pokarmowej PEM żywienie pozajelitowe przepisuje się pacjentom z ciężką chorobą w postaci kwashiorkoru z wyraźnymi zmianami dystroficznymi w przewodzie pokarmowym równolegle z rozpoczęciem żywienia dojelitowego. W przypadku wyczerpania w postaci marazmu, a także umiarkowanego stopnia PEM, przepisywane są mieszaniny dojelitowe. W zależności od sytuacji stosuje się dostęp sondą lub doustne podanie leku (powolne picie przez słomkę).
W przypadku znacznych niedoborów białkowo-energetycznych zaleca się stosowanie zbilansowanych mieszanek półelementowych, w przypadku umiarkowanego stopnia można zastosować standaryzowane podłoża polimerowe lub hiperkaloryczne mieszanki hiperazotowe.
Łagodną formę PEM kompensuje się zwykle łagodną dietą o wysokiej zawartości białka i energii (w warunkach placówki medyczne i profilaktyczne (HCI)- dieta wysokobiałkowa).
Specyficzne niedobory witamin i minerałów należy uzupełniać aktywnym leczeniem. Zwykle wymagana jest recepta na żelazo, magnez, wapń, fosfor, cynk, kwas foliowy i witaminę A. Z naszych obserwacji wynika, że dość często istnieje potrzeba stosowania kwasu nikotynowego w celu złagodzenia pelagry.
Uważa się, że rozsądne jest podawanie białka i kalorii w ilościach zbliżonych do zapotrzebowania tym pacjentom, których specyficzne niedobory zostały skorygowane i których infekcje zostały wyleczone. Aby osiągnąć dodatni bilans azotowo-energetyczny niezbędny do naprawy tkanek, należy zwiększyć ilość składników odżywczych.
U większości pacjentów jest to możliwe dzięki przywróceniu apetytu i zwiększeniu przyjmowania pokarmu doustnie. Jednak u niektórych pacjentów konieczne jest zwiększenie żywienia pozajelitowego.
Naszym zdaniem należy trzymać się dolnych granic zalecanych norm, gdyż wysokie spożycie białka (do 2,0 g/kg) często nie przekłada się na zaburzone zdolności metaboliczne do jego wchłaniania.
Kryteriami skuteczności leczenia są dodatni bilans azotowy i wzrost wskaźników odżywienia, przede wszystkim masy ciała. Natomiast u chorych na kwashiorkor w pierwszych dniach leczenia masa ciała z reguły zmniejsza się w wyniku ustąpienia obrzęku hipoalbuminemicznego, a następnie zaczyna wzrastać o około 100-150 g/dobę.
Rehabilitacja pacjentów często wiąże się z nieproporcjonalnym wzrostem masy ciała (nie z powodu białka, ale tkanki tłuszczowej), co wymaga dalszej korekty składu ciała.
Szczególnym problemem jest PEM, który rozwinął się w wyniku jadłowstrętu psychicznego. W tym przypadku żywienie terapeutyczne jest nieskuteczne bez oddziaływania psychoterapeutycznego. Pacjenci, a są to przeważnie młode dziewczęta, zgadzają się z zaleceniami dietetycznymi lekarza, jednak w tajemnicy wywołują wymioty po jedzeniu, stosują środki przeczyszczające i naśladują słabą tolerancję roztworów żywienia pozajelitowego. Przyczyną takiego zachowania jest strach przed otyłością lub nadmierną (z punktu widzenia pacjenta) masą ciała.
Na początkowym etapie interwencja psychoterapeutyczna powinna mieć na celu:
Przełamanie anozognozji wobec choroby, oczywistego lub ukrytego oporu wobec leczenia;
- korekta wyobrażeń pacjenta o idealnej masie ciała;
- korekta wyobrażeń pacjenta na temat sposobów kontroli i utrzymania masy ciała.
Wielu pacjentów z niedoborem białkowo-energetycznym nie docenia ciężkości swojego stanu i odmawia hospitalizacji. Niestety, czasami lekarze ambulatoryjni nawet przy ciężkim PEM nie oceniają odpowiednio sytuacji i nie nalegają na pilną hospitalizację. Umiarkowany i ciężki PEN, zwłaszcza ze zmniejszeniem puli białek trzewnych, należy leczyć w warunkach szpitalnych!
Należy zwrócić uwagę pacjenta na zagrażający życiu charakter zaburzeń somatoendokrynnych związanych z utratą masy ciała. Pacjent musi zrozumieć, że głównym wskaźnikiem powrotu do zdrowia jest przywrócenie masy ciała.
Na początkowych etapach leczenia dieta powinna być ściśle regulowana. Zachowania żywieniowe pacjentów są monitorowane przez personel pielęgniarski. Pacjenci prowadzą dzienniczek samoobserwacji, w którym odnotowują dzienne spożycie pokarmów, czas i sytuację spożywania posiłków.
W specjalnej kolumnie odnotowuje się stan psycho-emocjonalny (uczucia, emocje, myśli, zachowanie) podczas posiłków. Ważne jest, aby personel medyczny i krewni potępiali patologiczne zachowania żywieniowe i odwrotnie, chwalili i zachęcali do sukcesów osiągniętych w leczeniu.
A.Yu. Baranowski
Prawidłowe i pożywne odżywianie - warunek konieczny dla prawidłowego wzrostu i rozwoju dziecka.
Zdarzają się jednak sytuacje, gdy w organizmie dziecka występuje niedobór makro- lub mikroelementów. Prowadzi to do różnych rodzajów negatywne konsekwencje, opóźnienia w rozwoju fizycznym i intelektualnym.
O przyczynach i leczeniu niedożywienia białkowo-energetycznego u dzieci porozmawiamy w artykule.
Czym karmić dziecko, jeśli jest uczulone na mleko modyfikowane? Dowiesz się tego od nas.
Koncepcja i cechy

Niedożywienie białkowo-energetyczne jest stanem patologicznym powodowanym przez brak makroelementów z grupy białek.
Stan ten może szybko się rozwinąć, na przykład w okresach postu, gdy dziecko nie otrzymuje odpowiedniego pożywienia bogatego w białko.
PEM może również pojawiać się stopniowo, jeśli towarzyszą temu problemy w funkcjonowaniu przewodu żołądkowo-jelitowego upośledzone wchłanianie białka.
Powoduje
O procesie patologicznym możemy mówić w przypadku, gdy masa ciała dziecka gwałtownie spada, w ciągu ostatnich 6-12 miesięcy dziecko straciło na wadze. straciłem ponad 5-10% wagi.
Do tego zjawiska mogą prowadzić różne negatywne czynniki, takie jak:
- Złe odżywianie, spowodowane szeregiem przyczyn, takich jak np. niekorzystne warunki ekonomiczne rodziny, konieczność przestrzegania rygorystycznej diety w celach leczniczych, czynniki religijne, urazy aparatu szczękowego, które prowadzą do niemożności spożywania pokarmów w sposób naturalny . Do zaburzeń odżywiania mogą prowadzić także różnego rodzaju zaburzenia psychiczne, w szczególności anoreksja.
- Choroby, zaburzając proces trawienia i wchłaniania białka. Choroby te obejmują raka, cukrzycę i zaburzenia przewodu żołądkowo-jelitowego.
- Ryzyko rozwoju PEM wzrasta w okresie dojrzewania Kiedy zmienia się poziom hormonów u dziecka, obserwuje się szybki wzrost i rozwój organizmu. W tej sytuacji nastolatek potrzebuje większej ilości składników odżywczych, a jeśli nie dostarczy się ich w wystarczającej ilości, rozwija się patologia.

Kto jest zagrożony?
Najczęściej PEM występuje u dzieci żyjących w niesprzyjających warunkach, gdy dziecko nie ma możliwości, aby zjeść w pełni i prawidłowo. PEM często rozwija się u dzieci i młodzieży.
Jak dziecko może mieć alergię na gluten? dowiedz się już teraz.
Patogeneza
Niedobór makroskładników to stan, który organizm musi się dostosować. W procesie adaptacji odnotowuje się w nim różnego rodzaju zmiany. Zmiany te dotyczą przede wszystkim poziomu hormonów i aktywności układu hormonalnego.
Inne narządy wewnętrzne również cierpią, ponieważ nie otrzymują wystarczającej ilości pożywienia do normalnego funkcjonowania.
Do normalizować sytuację organizm redystrybuuje aminokwasy z tkanki mięśniowej i tłuszczowej do innych narządów, które tego potrzebują.
W rezultacie rozwija się podstawowy objaw PEM – utrata tkanki tłuszczowej i masy mięśniowej. Następuje spowolnienie procesów metabolicznych i gwałtowna utrata masy ciała.
Na początkowym etapie utrata masy ciała jest bardzo znacząca(4-5 kg tygodniowo), wówczas liczby te nieznacznie spadają, ale masa ciała nadal spada, choć nie tak szybko.
Klasyfikacja i etapy

Istnieją 2 główne formy BEN:
- marazm. Występuje opóźnienie wzrostu, zanik podskórnej tkanki tłuszczowej i mięśniowej;
- kwashiorkor. Obraz kliniczny w tym przypadku uzupełniają problemy w funkcjonowaniu wątroby (w jej komórkach gromadzą się elementy tłuszczowe, których normalnie nie powinno być), a u dziecka pojawiają się obrzęki. Stan tkanki tłuszczowej podskórnej pozostaje niezmieniony.
W zależności od ciężkości przebiegu wyróżnia się kilka form patologii:
- Łagodny I stopień. Charakteryzuje się osłabieniem organizmu, obniżoną odpornością i zwiększonym zmęczeniem. Dziecko szybko się męczy, czuje się senne i często odmawia zabaw na świeżym powietrzu.
- Umiarkowany II stopień. Występuje opóźnienie w wzroście i wadze. Dziecko jest najbardziej podatne na różnego rodzaju wirusy i infekcje i często choruje, ponieważ układ odpornościowy zmienia się na poziomie komórkowym.
- Ciężki stopień. Występuje wyraźne opóźnienie wzrostu, masy ciała i osłabienia tkanki mięśniowej, co jest szczególnie widoczne w kończynach. Występują zaburzenia w funkcjonowaniu przewodu żołądkowo-jelitowego. Objawia się to biegunką i bólem brzucha po jedzeniu. Włosy dziecka stopniowo zaczynają wypadać, pogarsza się jakość skóry i paznokci. Metabolizm płynów w tkankach organizmu zostaje zakłócony, co prowadzi do rozwoju obrzęków.
- Izolowana forma. W tym przypadku mówimy o niewystarczającym poziomie wielu niezbędnych mikro i makroelementów w organizmie.
Zakłócone zostaje funkcjonowanie narządów wewnętrznych, które bez otrzymania wystarczającej ilości składników odżywczych nie mogą normalnie wykonywać swoich funkcji.
Możliwe powikłania i konsekwencje

Niedobór białka i kalorii – stan niebezpieczny dla zdrowia dziecka co może prowadzić do różnych niekorzystnych konsekwencji.
Obejmują one:
- utrzymujący się spadek odporności, powstawanie niewystarczającej odpowiedzi immunologicznej na czynniki drażniące. Prowadzi to do częstych chorób zakaźnych, z których wiele może powodować znaczne szkody dla zdrowia i rozwoju;
- (dzieci najczęściej mają niedobór witamin B i A). Może to prowadzić do wysuszenia skóry, pojawienia się plam starczych, zmian w błonach śluzowych organizmu i rozwoju procesów zapalnych. Rozwijają się zaburzenia nerwowe, takie jak apatia, depresja i zaburzenia snu. Ponadto niedobór witamin prowadzi do występowanie różnego rodzaju chorób(zapalenie spojówek, zapalenie języka, leukopenia i wiele innych);
- z PEM jest to możliwe zaburzenie metabolizmu minerałów, co prowadzi do problemów z układem mięśniowo-szkieletowym (na przykład osteoporoza);
- czynność serca jest zaburzona, inne narządy wewnętrzne.
Objawy i obraz kliniczny
Objawy patologii mogą być różne. Przede wszystkim to zależy od ciężkości choroby. Zatem przy łagodnym niedoborze białka i energii obraz kliniczny jest słabo wyrażony, dziecko skarży się głównie na złe samopoczucie i osłabienie.
Jeśli PEM jest cięższy, obraz kliniczny jest bardziej zróżnicowany. Tutaj główne cechy charakteryzujące PEN:

Diagnostyka
Diagnozę choroby przeprowadza się etapami. Przede wszystkim lekarz ocenia stan fizyczny pacjenta według takich kryteriów jak:
- wskaźniki wzrostu i masy ciała;
- ocena wskaźników fizycznych i emocjonalnych (uwaga, szybkość reakcji, częstotliwość chorób zakaźnych itp.);
- ocena stanu skóry;
- napięcie mięśniowe (w przypadku PEM jest zmniejszone);
- ocena rozwoju podskórnej warstwy tłuszczu;
- ocena diety dziecka (przeprowadzana co tydzień).
Obowiązkowe badania laboratoryjne:

Dodatkowe badania:
- immunogram;
- badania genetyczne;
- badania sprzętu.
Informacje na temat leczenia zespołu astenicznego u dzieci znajdziesz na naszej stronie internetowej.
Leczenie
Głównym celem terapeutycznym PEM jest normalizacja procesów metabolicznych w organizmie, gdy podaż składników odżywczych jest większa niż ich spożycie. Oprócz pożywnej diety dziecku przepisuje się odpoczynek (w przypadku ciężkiej patologii - odpoczynek w łóżku), a także utrzymanie ciepła.
Dieta dziecka powinna składać się głównie z pokarmów bogatych w łatwo przyswajalne składniki.
Posiłki powinny być ułamkowe, to znaczy liczba posiłków wynosi 5-6 razy dziennie, wielkość porcji jest niewielka. Musisz jeść te produkty Jak:

Należy pamiętać, że dieta powinna być jak najbardziej łagodna, ale nie mniej kompletna. Nie zaleca się dużych posiłków ilość spożywanego pokarmu musi odpowiadać normom dla wieku i wagi dziecka. Podstawowym warunkiem jest urozmaicona dieta, bogata w mikro i makroelementy.
Prognoza
Niedobór białkowo-energetyczny jest stanem, który może prowadzić do śmierci (według statystyk śmiertelność wśród dzieci cierpiących na tę patologię wynosi 5-40%).
Wszystko zależy od ciężkości choroby, jej objawów klinicznych, a także od Jak skuteczne było przepisane leczenie?.
Zapobieganie

Rozwojowi PEM można zapobiec, przestrzegając następujących zasad:
- Prawidłowe zachowanie(dobre odżywianie, brak złych nawyków, wystarczający odpoczynek) dla przyszłej matki w okresie rodzenia dziecka.
- Karmienie piersią przez możliwie najdłuższy okres, terminowe wprowadzanie pokarmów uzupełniających.
- Jeśli dziecko jest karmione butelką, więcej Uważnie monitoruj wzrost i przyrost masy ciała.
- Wzmocnienie układu odpornościowego, organizowanie prawidłowego planu dnia i diety.
PEM u dziecka może prowadzić nie tylko do opóźnienia fizycznego, ale także umysłowego w rozwoju. Ponadto, ten stan zagraża życiu dziecka, ponieważ narządy wewnętrzne i układy jego ciała nie są w stanie normalnie wykonywać swoich funkcji w przypadku braku normalnego odżywiania.
Uprzejmie prosimy o niesamoleczenie. Umów się na wizytę do lekarza!